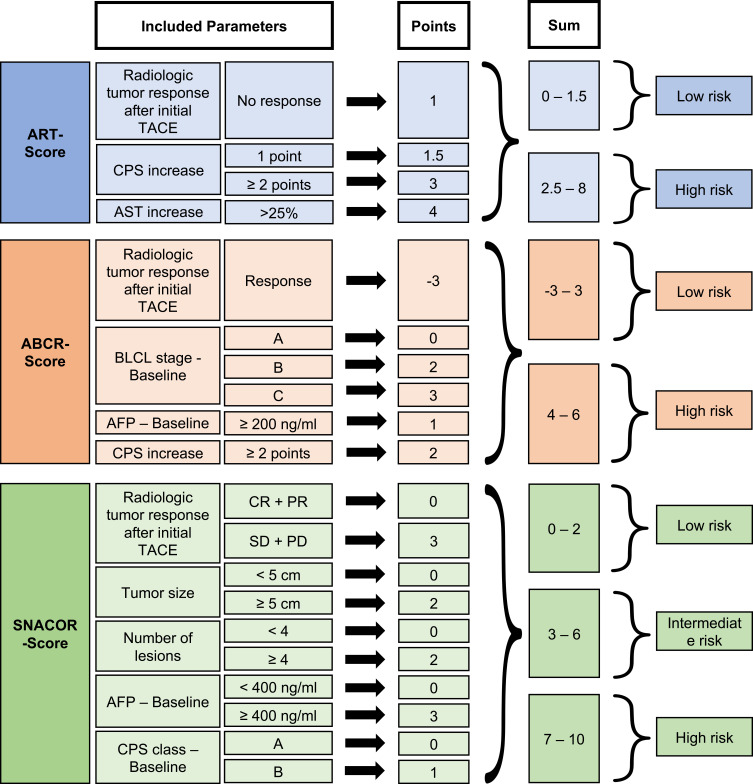
与上述评分在TACE初始时(TACE术前评分)的结果相似,所有用于继续TACE的评分系统(TACE术中评分)均未能通过独立的外部验证,在个体预后预测方面仅具有中等准确性。有作者Lukas Muller 使用自己的数据对ART和ABCR评分进行验证表明,两种评分系统均能够根据患者的中位OS对患者进行分层【Kloeckner R 2017】。对于其患者队列,ABCR评分略准确。然而,两种评分在个体预后预测方面的价值均为中等。此外,Lukas 评估了SNACOR评分,该评分也有能力根据中位OS对患者进行显著分层,但在个体预后预测方面失败【Mähringer-Kunz A 2018】。
根据所有这些相当令人失望的结果,EASL指南专家组认为评分系统的使用存在争议,并建议当两轮治疗后未达到实质性坏死或后续治疗未能在初始肿瘤缓解后进展的部位诱导明显坏死时,不应重复TACE【Galle PR, 2018】。
总之,上述所有评分均可评估预后,但不能支持明确的临床决策。因此,作为一个由经验丰富的肝胆外科医师、肝病科医师、介入放射科医师和肿瘤科医师组成的跨学科肿瘤委员会,有必要讨论每次TACE治疗的适应证。特别是,必须考虑肝脏肿瘤的范围、肝功能和患者的体能状态。最后,患者的意见应成为决策过程中不可分割的一部分。特别是TACE治疗的利弊及对预后的影响应在决策中发挥重要作用。
当前的评分系统:为什么他们倾向于失败/表现不佳?
评分系统的验证结果令人沮丧,一个可能的原因可能是绝大多数HCC患者合并肝硬化,这使预测变得复杂。尽管一些评分试图考虑这两个方面,但仅使用3 ~ 5个参数可能是对更为复杂的临床现实的不适当简化。
之前描述的所有系统都是基于或多或少相同的数学原理创建的: 多变量回归分析中显著参数的系数因子是基于经过精心选择的队列的数据集进行调整的加权因子。因此,过拟合可能是与该方法相关的一个方法学问题。过拟合描述的是“当一个模型在某些数据集上的性能最大化,但由于不同临床和人口统计学背景下患者特征的随机波动,其预测性能无法在其他地方得到证实时出现的一种现象”【Facciorusso A 2015】。大多数分数是在单一机构创建的,这可能加剧了过度拟合的问题。此外,大多数研究仅基于中等样本量。
基于人工智能的新方法
为了克服这些局限性,在肝癌患者的TACE治疗中使用人工智能(AI)进行了几次尝试【Abajian A 2018;
Peng J 2020;
Mahringer Kunz 2020;
Liu D 2020】。这些尝试可分为两组。Peng等人,ababjian等人,Liu等人专注于训练基于人工智能的系统,该系统可以在第一次治疗前估计TACE治疗的反应。Peng等人使用CT图像进行模式识别【Peng J 2020】该方法在训练和验证中均具有良好的准确性。为了评估TACE后的肿瘤反应,abajan等基于肿瘤的两个MRI特征和三个临床参数构建了一个模型【Peng J 2020】。虽然他们的系统的准确性稍低,但这次尝试强调了基于人工智能的解决方案的能力。最近,Liu等证明了使用超声造影电影进行生存预测的基于深度学习的影像组学模型的可行性【Liu D 2020】Mähringer-Kunz等人最近报告了另一种幸运方法的结果:目的是训练一个基于ai的网络来预测1年生存率【Mahringer Kunz 2020】。为了提高预测的准确性,他们纳入了46个参数,包括肿瘤相关特征,如肿瘤大小、病灶数量和肿瘤生长模式,用于评估肝功能的参数,HCC发展的危险因素,以及新的荟萃参数,如骨骼肌指数。他们的新方法在训练和验证队列中取得了良好的结果,ROC曲线下面积分别为0.77和0.83。在预测1年生存率方面,该方法的效果优于ART、ABCR和SNACOR评分。
所有这些基于人工智能的系统的好处是它们的动态学习过程;随着来自不同机构的更多可用和完整的数据集,这些系统的准确性可能会进一步提高。然而,建议的系统必须在外部、多中心评估中证明其准确性。此外,与现有的分层系统相比,临床决策中的额外获益有多大仍有待探讨。
