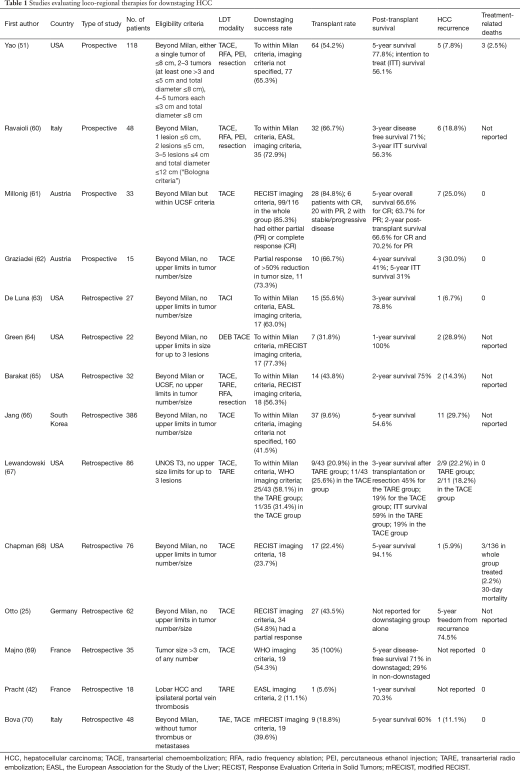
降期治疗,是指将不可切除的肿瘤通过治疗变成可切除性肿瘤。又称为为转化治疗。Transformation 或 transmission 包括: 1. ,降期有助于超出米兰标准的肝细胞癌患者接受肝移植;成功降期至米兰标准的比例‘’然而,最佳方案和降期结局尚不明确。还有接受降期的患者中肝移植后的复发率和生存率。 2. 降期后肝切除的比例? 降期后接受肝切除患者的复发率和生存率? 法国Paul Brousse 医院的Majno及其同事首先测试了应用LRT(肝局部治疗)缩小肝细胞癌大小以促进切除术或LT的概念【Majno PE 1997】。最近的一些研究已经正式评估了HCC的降期,其中大多数研究使用米兰标准作为降期的终点。在美国国家癌症研究所的共识会议上,HCC的降期被确定为HCC肝移植领域的研究重点。然而,截至目前,大多数已发表的数据受到样本量小和随访时间短的限制,无法全面评估肝移植术后HCC复发的风险;无降期对照组。
对局部区域治疗的应答应根据改良的实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, mRECIST)进行评估,该标准同时评估肿瘤体积的变化和动脉强化情况。通过CT或MRI评估肿瘤的大小,仅考虑存活肿瘤的最大大小【Lencioni R 2010】。EASL标准也只评估存活肿瘤:通过CT的非增强区域识别的存活肿瘤体积的缩小【Bruix J 2001】。世界卫生组织(WHO)也制定了降期成功的标准,与mRECIST标准一样,这些标准是基于整个病变,而不仅仅是可行区域(最大病变垂直直径乘积减少50%)。根据UNOS TNM分期对肿瘤的新维度进行分类,以评估分期是否降至列表标准内。降期的定义通常是达到米兰标准。
LDT(Liver-Directed Therapy)失败可表现为转移和血管侵犯,以及进展至超出降期标准。如果发生肿瘤进展,但活性肿瘤负荷仍在降期的纳入标准内,则应暂停移植并重复LDT,直至达到降期终点,从而再次适合移植(53)。
为了解决肝癌局部治疗试验报告的异质性,Parikh提出了这一领域未来研究报告的最低标准。Yao提出了一个标准化的降期方案,包括纳入标准和降期成功或降期失败的标准。
肝癌的降期治疗需要回答的问题包括 1. 什么是肝癌的降期治疗 2. 肝癌降期治疗的适应症 3. 肝癌降期治疗的方法 4. 肝癌降期治疗的效果
|
 |
 |
 |
|
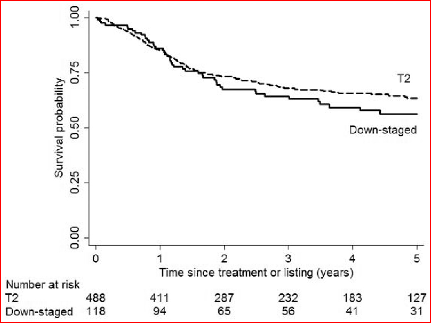
0时间为降期组首次降期治疗时间,T2时间为列示肝移植时间。生存率的差异无统计学意义(p=0.29)。
|
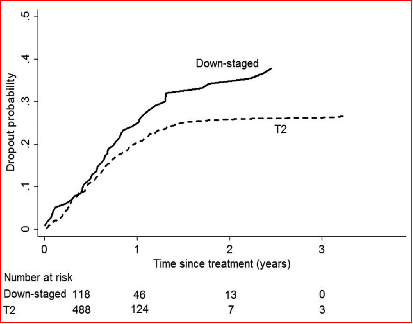
0时间为降期组首次降期治疗时间,T2时间为列示肝移植时间。退出概率的差异具有统计学意义(p=0.04)。
|
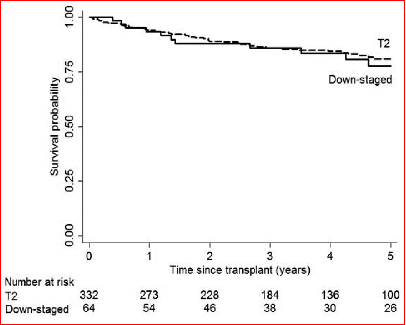
时间零点为两组肝移植日期。生存率的差异无统计学意义(p=0.69)。
|
TACE 降期治疗的危险
这些治疗的缺点包括:
1. 栓塞后综合征是TACE/TAE最常见的不良反应:一种自限性疾病,在术后48小时内表现为腹痛、发热和肝酶升高,见于60%的患者。
2. TACE的副作用还包括与化疗相关的症状:恶心、呕吐、骨髓抑制、肾功能不全。
3. 其他TAE和TACE 引起的不良事件包括
- 胆管损伤
- 坏死肿瘤的肝脓肿
- 缺血性胆囊炎
- 肝硬化腹水的失代偿、合成功能恶化(失代偿的风险取决于术前肝功能)
1. 栓塞后综合征是TACE/TAE最常见的不良反应:一种自限性疾病,在术后48小时内表现为腹痛、发热和肝酶升高,见于60%的患者。
2. TACE的副作用还包括与化疗相关的症状:恶心、呕吐、骨髓抑制、肾功能不全。
3. 其他TAE和TACE 引起的不良事件包括
- 胆管损伤
- 坏死肿瘤的肝脓肿
- 缺血性胆囊炎
- 肝硬化腹水的失代偿、合成功能恶化(失代偿的风险取决于术前肝功能)
- 潜在的死亡,
因此LDT研究中的患者选择对报告的不良结局有显著影响。在有腹水的情况下,TACE相关肝衰竭的发生率为17%,1年死亡率高【 Hsin IF 2011】。由于各中心的TAE/TACE方案不同,因此动脉选择性栓塞的决策也会影响预后。一项系统综述报告,在37项试验(包括2,878例患者,35例)中,与治疗相关的中位死亡率为2.4%。
因此LDT研究中的患者选择对报告的不良结局有显著影响。在有腹水的情况下,TACE相关肝衰竭的发生率为17%,1年死亡率高【 Hsin IF 2011】。由于各中心的TAE/TACE方案不同,因此动脉选择性栓塞的决策也会影响预后。一项系统综述报告,在37项试验(包括2,878例患者,35例)中,与治疗相关的中位死亡率为2.4%。
经皮治疗可发生沿针道生长的肿瘤。RFA的不良反应风险高达10%,包括胸腔积液和腹腔出血,手术相关死亡率为0 ~ 0.3%。
TARE最常见的治疗副作用是疲劳和持续7 ~ 10天的一过性非特异性流感样症状,见于60%的患者。
最后,分期降低的最终潜在危害是增加了移植后HCC的复发率,这可能意味着对有限的供体器官的利用不足。
降期治疗的进展
肝移植为大多数非转移性肝细胞癌(HCC)患者提供了治愈的最佳机会。虽然并非所有HCC患者在诊断时都适合肝移植,但一些患者可通过局部治疗(如消融和经动脉化疗栓塞)降低分期。上述治疗被用作过渡治疗,以使患者保持在移植标准内,并避免他们在等待肝移植期间从等待名单中退出。
此外,免疫疗法在支持降期和过渡治疗方面可能具有巨大潜力。为了阐明目前HCC肝移植中降期、过渡治疗和免疫治疗的现状,欧洲器官移植学会(ESOT)召集了一个由HCC治疗专家组成的专门工作组,对文献进行了综述,并制定了与这一原因相关的指南,这些指南随后在布拉格亲自举行的移植学习之旅(TLJ) 3.0共识会议上进行了讨论和投票。
欧洲器官移植学会(ESOT)关于肝细胞癌肝移植的降期、桥接和免疫治疗的共识报告(European Society of Organ Transplantation (ESOT) Consensus Report on Downstaging, Bridging and Immunotherapy in Liver Transplantation for Hepatocellular Carcinoma)
肝移植为大多数非转移性肝细胞癌(HCC)患者提供了治愈的最佳机会。米兰标准 (单个≤5 cm 的病灶或 2 ~ 3个≤3 cm的病灶)
在1996年引入后成为[1]患者适合移植的标准。在后来的几年里,几个扩展的选择标准被引入。其中,加州大学旧金山分校(University Of California San Francisco, UCSF) 标准 (单个病灶 ≤6.5 cm 或 2 ~ 3个病灶≤4.5 cm,总直径≤8 cm)、up to -seven标准 (最大肿瘤大小 [以cm为单位]和肿瘤数量之和不应超过7个)和法国AFP模型 (AFP水平、肿瘤大小和数量之和不应超过2个的评分)被最广泛接受。在这些既定标准下进行移植的患者的移植后5年生存率超过70%,10年生存率超过60%。为了使患者在等待移植期间保持在这些标准内,并避免其从等待名单中退出,目前正在应用消融和经动脉化疗栓塞(TACE)等桥接治疗。同样,这些治疗可将超出既定HCC移植标准的患者降期至符合这些标准,从而使其符合肝移植的条件。当成功时,降期患者可以获得同样有意义的移植后5年和10年生存率,分别超过65%和50%。
在1996年引入后成为[1]患者适合移植的标准。在后来的几年里,几个扩展的选择标准被引入。其中,加州大学旧金山分校(University Of California San Francisco, UCSF) 标准 (单个病灶 ≤6.5 cm 或 2 ~ 3个病灶≤4.5 cm,总直径≤8 cm)、up to -seven标准 (最大肿瘤大小 [以cm为单位]和肿瘤数量之和不应超过7个)和法国AFP模型 (AFP水平、肿瘤大小和数量之和不应超过2个的评分)被最广泛接受。在这些既定标准下进行移植的患者的移植后5年生存率超过70%,10年生存率超过60%。为了使患者在等待移植期间保持在这些标准内,并避免其从等待名单中退出,目前正在应用消融和经动脉化疗栓塞(TACE)等桥接治疗。同样,这些治疗可将超出既定HCC移植标准的患者降期至符合这些标准,从而使其符合肝移植的条件。当成功时,降期患者可以获得同样有意义的移植后5年和10年生存率,分别超过65%和50%。
尽管免疫治疗仍处于发展阶段,并且只是最近才作为晚期HCC患者的一线治疗的一部分,但免疫治疗在进一步治疗HCC方面也提供了巨大的潜力。在各种实体瘤类型的早期试验和HCC中,免疫治疗在新辅助治疗中的证据已经积累,很少有研究显示有前景的结果,报告20%-42%的切除患者接受新辅助免疫治疗后出现主要病理反应(≥70%坏死)。
为了阐明在HCC肝移植的特定背景下,降期、过渡治疗和免疫治疗在这两种策略中的当代地位,ESOT召开了一个由肝脏病学专家、移植外科医生和肿瘤学家组成的全球专家组的共识会议,旨在制定关于肝细胞癌肝移植降期、过渡治疗和免疫治疗关键方面的指南。这些ESOT共识指南的共识结果和建议在本文中给出,供医疗保健提供者参考。