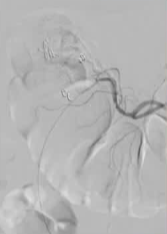
| 下消化道出血(LGIB)是美国每年30万住院的主要原因。【Billingham RP 1997】通过现代影像学和内镜技术,大多数胃肠道(GI)出血的患者都能得到适当的诊断和治疗。如果上消化道镜检、结肠镜检、小肠镜检和胶囊内镜等内镜干预措施无法定位出血部位,则采用红细胞(RBC)标记的闪烁扫描、计算机断层扫描(CT)血管造影和常规血管造影等影像学研究。 然而,尽管进行了多次放射学和内镜检查,仍有高达5%的患者需要多次住院和输血【Steger AC 1988】。[2] 为了提高这类患者的诊断准确性,开发了激发性肠系膜血管造影(PMA)技术,通过在标准血管造影方案中加入包括肝素、硝酸甘油和组织型纤溶酶原激活剂(TPA)在内的药物来增加诊断效果。该技术最好用于近期有胃肠道出血的患者,并允许同时进行治疗性栓塞。文献报道的该技术在定位出血方面的成功率不到50%【Kim CY 2010】。 如果生命体征稳定或复苏情况下稳定,甚至生命体征不稳定患者因为消化道大出血从急诊室紧急到CT室进行CTA或者去导管室进行DSA,发现造影剂外溢的直接征象只有50%-70%。 这是临床面临的尴尬情况:The Problem is the time of active bleeding often intermittent
为了确定出血点,必须在出血发生时进行血管造影检查(药物性血管造影),而这种检查往往是间歇性的……
- 一次,两次或再次内镜检查一次,两次或/再次血管造影
激发 Provocation?
一种经典的方法
用于刺激出血部位
使用 去甲肾上腺素 Arterenol
上消化道出血患者初次内镜检查结果为阴性并且是...... 初始血管造影结果为阴性
用于检测出血部位 去甲肾上腺素在消化道造影中是一种罕见的、特殊情况下使用的辅助药物,用于增强某些病变的显示,尤其是在怀疑有活动性出血时。去甲肾上腺素是一种强效的血管收缩剂,是人体内自然存在的儿茶酚胺类神经递质和激素。在临床上,它主要作为抢救药物,用于:
升高血压(用于感染性休克等危重情况)
收缩血管,减少局部出血
药物性血管造影之血管收缩剂辅助造影的核心原理是:
去甲肾上腺素能使胃肠道的血管(特别是小动脉)强烈收缩,从而:
减少或暂时停止黏膜的微小出血。
让正常黏膜的血管纹理暂时消失或变淡。
突出显示异常血管或出血点,因为肿瘤等病变组织内的血管往往对血管收缩剂不敏感(缺乏正常收缩功能)。
主要应用场景:
怀疑有小活动性出血,但常规造影和内镜未发现:当患者有间歇性黑便或潜血阳性,但胃镜、肠镜和常规钡餐检查阴性时,可以考虑。注射去甲肾上腺素后,正常黏膜变白、出血停止,如果仍有造影剂(通常是碘剂而非钡剂)外渗或异常血管显影,则提示出血点或血管畸形(如动静脉畸形、血管瘤)的位置。
协助鉴别诊断黏膜下肿瘤:有时用于区分肿瘤的性质,但现已基本被更先进的内镜超声(EUS)和增强CT所取代。
如果您在病历或文献中看到这个组合,它很可能是一个历史案例,或是极其特殊情况下(如无其他设备可用)的考虑。当前对于消化道出血或肿瘤的标准诊断流程完全不需要依赖这种方法。
历史用法:在过去CT、血管造影技术不发达的年代,这种方法曾被探索用于诊断。如今,其诊断价值已远低于直接的内镜检查和血管造影。
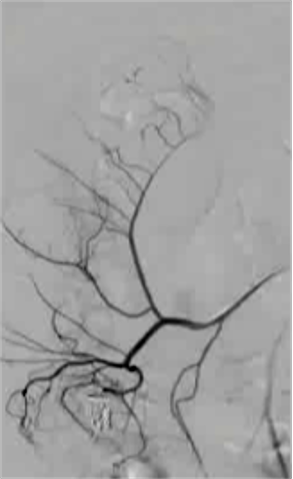
消化道大出血
文献中药物血管造影还有的激发药物
血管扩张剂:托拉唑啉
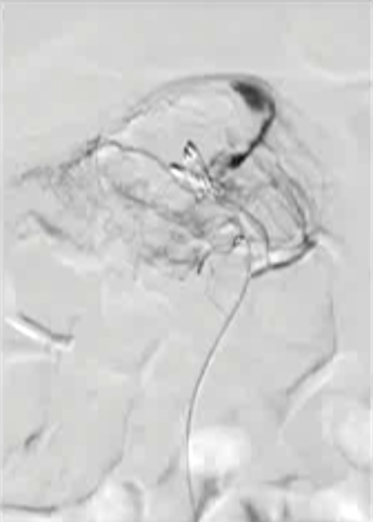
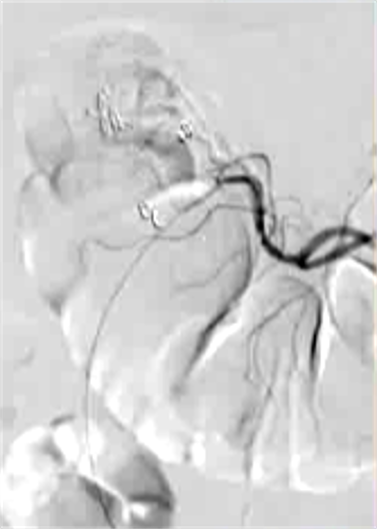
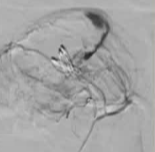
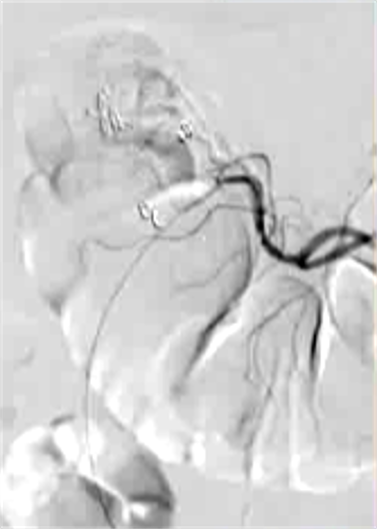
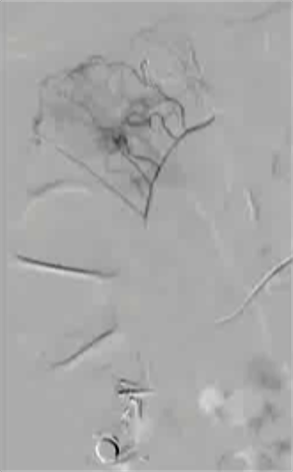
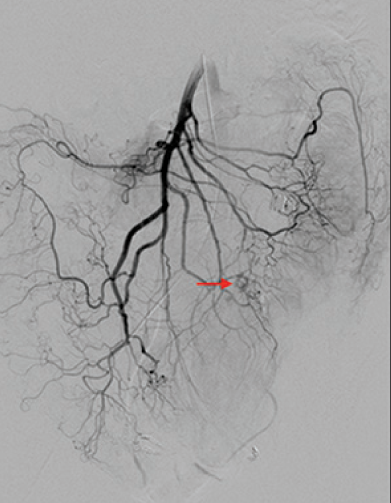
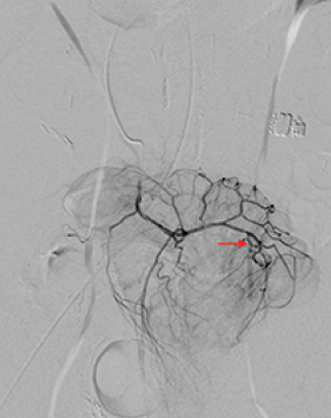
抗凝剂:肝素 溶栓药物:尿激酶、阿替普酶  7 名患者 在动脉内内给予托拉唑啉、肝素、尿激酶进行血管造影操作 2 名患者出现出血性诱因情况 外科治疗  回顾性分析(2002 年至 2008 年) 34 名患者(年龄 7 至 92 岁),36 例刺激性肠造影检查 全身性使用肝素 动脉内给药的血管扩张剂 11 名患者(占 31%)出现出血情况的检测结果。 10 栓塞治疗 病例1 消化道大出血 血压 70/40mmGg
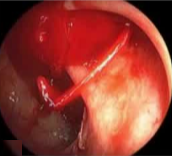
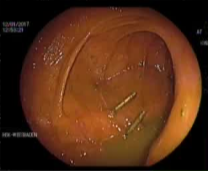
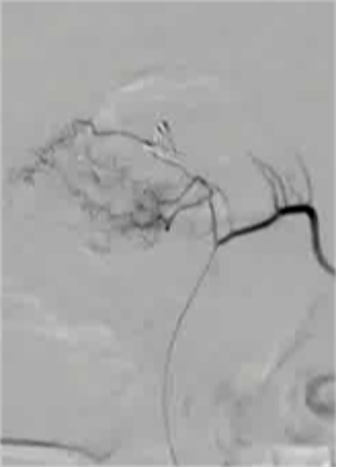
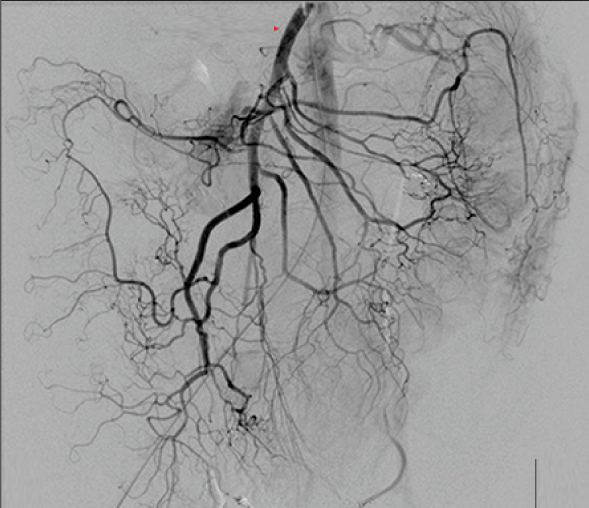
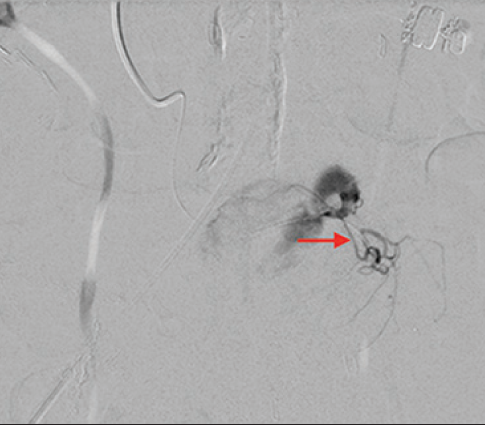
病例三 77岁女性复发性胃肠道出血,需要多次输血并入住ICU。(d)栓塞后无外渗。箭头指向栓塞部位。
激发试验药物剂量和结果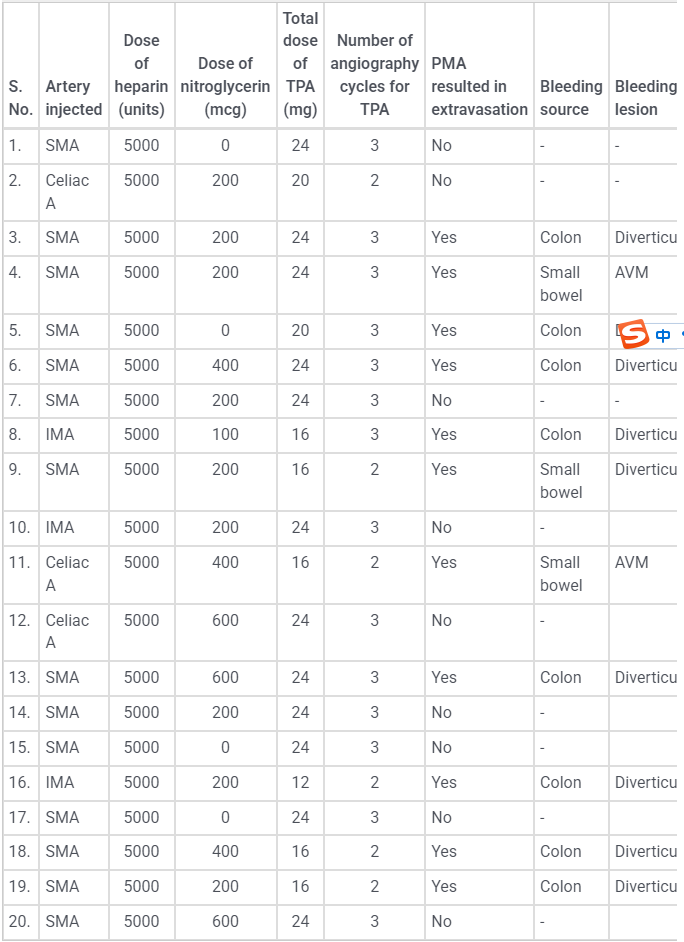 、、  本文是一篇发表在《Journal of Gastrointestinal Surgery》上的研究通讯文章,题目为“Provocative Mesenteric Angiography: Outcomes and Standardized Protocol for Management of Recurrent Lower Gastrointestinal Hemorrhage”。该研究旨在评估激发肠系膜血管造影(PMA)在复发性下消化道出血中的有效性和并发症,并探讨是否可以在多学科环境中建立一种技术操作规程。 研究方法研究团队回顾了其机构在过去12年(2008年至2020年)期间进行的下消化道出血肠系膜血管造影的数据,基于CPT代码75726筛选出符合条件的病例。进一步分析了其中的PMA病例,排除了医源性、手术性或创伤性原因引起的下消化道出血。挑衅性造影的诱导方案包括使用硝酸甘油扩张血管、肝素抗凝以及组织纤溶酶原激活剂(tPA)溶解血栓。 研究结果在12年的研究期间,共进行了36例PMA。其中16例(44%)为阳性结果,20例(56%)为阴性结果。阳性组和阴性组之间在患者人口统计学特征、既往下消化道出血史、先前住院次数、Charlson合并症指数评分或术前血红蛋白水平方面没有显著差异。所有阳性病例均接受了栓塞治疗,且无出血并发症,无再出血事件,也未出现缺血性肠病后遗症。尽管有两名患者(12.5%)在30天内因复发性出血再次入院,但这一比例显著低于在阴性研究中再出血的60%。 结论本研究是迄今为止最大的文献,表明PMA在适当选择的患者中能够成功诱发和治疗下消化道出血。此外,该程序是安全的,即使使用较高剂量的tPA,也没有发生出血或缺血性肠病并发症。研究机构采用了一种修改后的现有社会指南协议,将PMA纳入下消化道出血的管理流程。 其他信息文章还提到了一些相关的参考文献和被引用的文章,涉及早期与标准结肠镜检查、急性下消化道出血的门静脉造影预测因素和结果、隐匿性胃肠出血的挑衅性肠系膜血管造影更新等内容。这些文献提供了更多的背景信息和相关研究支持。 激发血管造影并发症 与“激发”试验直接相关的并发症
这是消化道出血血管造影特有的风险。当首次造影未发现出血点时,为诱发或增强出血征象,会使用药物进行“激发”。
使用血管扩张剂(如罂粟碱、托拉唑林、前列腺素):
主要目的:降低动脉压,解除可能存在的血管痉挛,使出血点显影。
主要风险:诱发或加剧出血。这是最核心的并发症。药物可能使原本已止血的血管破裂处重新出血,或使小出血点变成大出血,导致患者血流动力学不稳定。
全身性低血压:药物可能导致全身血管扩张,引起血压下降。
使用抗凝/抗栓剂(如肝素、尿激酶):
主要目的:溶解可能堵塞出血点的微小血栓,使造影剂外溢显影。
主要风险:
出血加重:与血管扩张剂类似,但机制是抗凝/纤溶,风险可能更高。
系统性出血:可能引发其他部位出血,如颅内出血、胃肠道其他部位出血、穿刺点血肿增大等。
过敏反应(尤其是链激酶、尿激酶)。
风险分层与影响因素
并发症的发生风险与以下因素密切相关:
患者状况:年龄、肾功能、凝血功能、有无高血压/动脉硬化、血流动力学是否稳定。
操作者经验:技术熟练度可显著降低穿刺和插管相关风险。
药物选择与剂量:激发药物的种类、剂量和给药速度直接影响出血风险。
出血病因:溃疡、肿瘤、血管畸形等,对激发试验的反应和风险不同。
|