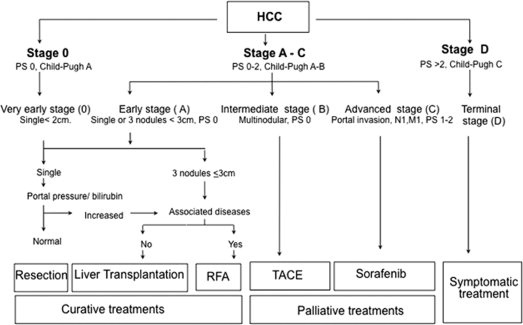
| “治疗阶段迁移"(treatment stage migration or Treatment Stage Migration in Liver Cancer)这是一个非常重要且专业的肿瘤学概念。这一概念的正式定义最早由欧洲肝脏研究学会(EASL-欧洲癌症研究与治疗组织-European Organisation for Research and Treatment of Cancer)于 2012 年提出:: “在每个 (BCLC) 阶段中,有一部分选择患者并不完全符合治疗分配的所有标准。在这种情况下,建议为患者提供同一阶段内最合适的下一个治疗方案(如早期肝癌肝切除,肝移植和射频消融),或者提供下一个预后阶段的治疗方案(对于经动脉化疗栓塞失败或HCC进展更严重的患者)。”(下图)【Bruix J, 2011】(11)。两年后,巴塞罗那临床肝癌(BCLC)的作者也给出了类似的定义:“对患者的精细评估可能表明,在 BCLC 模型中作为首选考虑的治疗方案并不安全或不可行。因此,所选方案将对应于不同的发展阶段。这种现象被称为治疗阶段迁移。”【Reig M 2014】 BCLC分期系统(图2)[11]在临床实践中已被广泛接受,也用于许多治疗HCC的新药临床试验。因此,它已成为实际应用的分期系统。
2018 年欧洲肝脏研究学会(EASL)指南给出了如下定义:
|
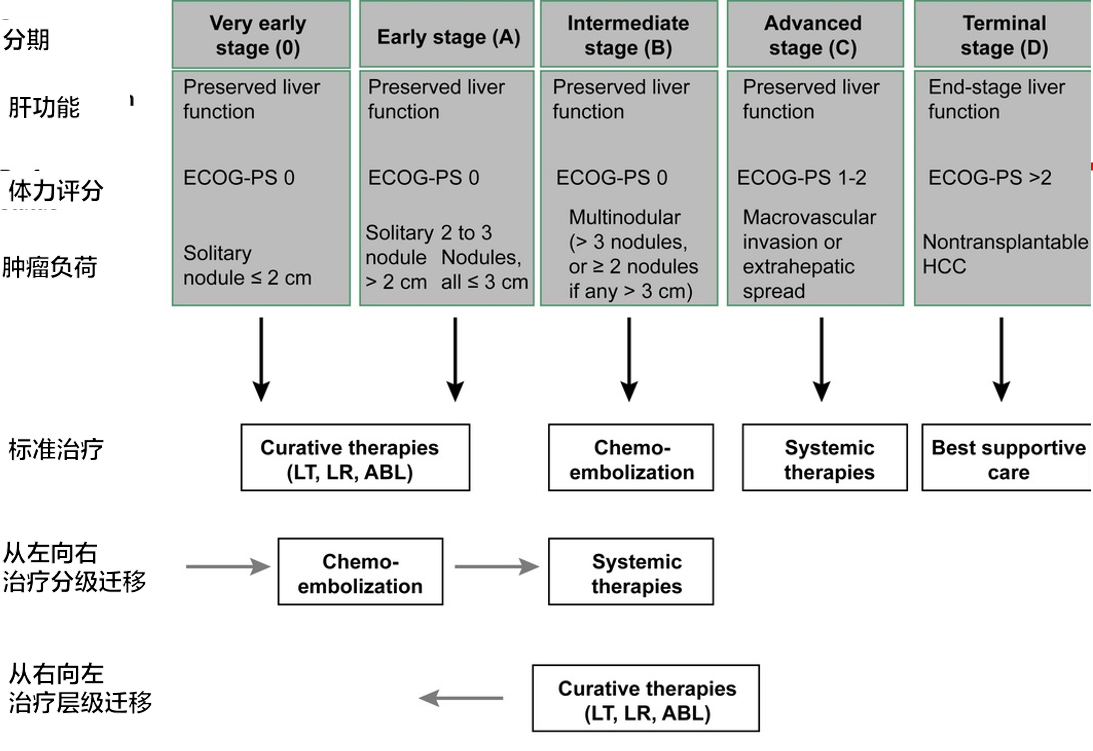 |
| 根据最2018版欧洲肝脏研究学会(EASL)指南提出的“治疗阶段迁移”概念【EASL 2018】。该方法表明,除了早期阶段(0 期和 A 期)外,每个阶段都采用单一疗法,且推荐疗法不一定优于其他潜在可行的治疗方案。该方法仅在阶段关联疗法不可行时(即从左向右的方向)才允许转向另一种治疗方案,或者在标准治疗对个体而言明显治疗不足时(即从右向左的方向)根据个体情况“回退”到之前的疗法。ECOG-PS,东部肿瘤协作组体能状态。 |
目前对治疗阶段的迁移的核心定义是
治疗阶段迁移,也称为 Will Rogers 现象(Will Rogers Phenomenon),是指由于诊断技术或筛查方法的进步,疾病(如肝癌)能够在更早、更精确的阶段被发现和分类。
这导致两个主要结果:
“迁移”到更早阶段:原本在旧技术下会被划分为晚期(例如B期或C期)的患者,现在因为更精确的检查(如更灵敏的影像学或生物标志物)而被重新划分到更早的阶段(例如A期或B期)。
“迁移”到更晚阶段:同样,一些原本被认为是早期的患者,因为发现了之前检测不到的微小转移灶,而被重新划分到更晚的阶段。
最终结果是,每一个分期的患者群体的生存率都得到了“虚假”的提高,但这并不一定是治疗方法本身变得更有效,而是因为分期的“纯度”提高了——每个阶段内的患者群体都变得更“同质”,晚期组剔除了那些其实预后稍好的患者,早期组也剔除了那些其实预后稍差的患者。
肝癌的治疗阶段迁移主要由以下几方面的进步所驱动:
1. 影像学技术的革命性进步
过去:主要依赖超声(US)和计算机断层扫描(CT),对于小于1-2厘米的病灶检出率低。
现在:多模态磁共振成像(MRI):特别是使用肝细胞特异性造影剂(如钆塞酸二钠,Gd-EOB-DTPA)的MRI,对微小肝癌(<1cm)的检出和定性能力极大提升。
增强CT:扫描速度和分辨率提高,能发现更小的病变。
普美显MRI:能发现常规影像学难以检出的微小病灶和癌前病变,使分期更加精确。
2. 血清生物标志物的应用
甲胎蛋白(AFP):传统标志物,但敏感性和特异性有限。
新型标志物:如甲胎蛋白异质体(AFP-L3%) 和脱-γ-羧基凝血酶原(DCP),也称为PIVKA-II。联合检测可以提高早期诊断率,将一些仅凭影像学难以定性的患者正确分期。
3. 肝癌分期系统的演进和治疗技术的多样化
分期系统:从简单的OKUDA分期,到更精细的BCLC(巴塞罗那临床肝癌分期)、TNM分期等。这些系统不断整合肝功能、肿瘤负荷、体能状态等多维度信息,使分期更精准,指导治疗更个体化。
治疗技术:肝移植、射频/微波消融(RFA/MWA)、经动脉化疗栓塞(TACE)、靶向治疗、免疫治疗等的出现和发展,意味着即使对于同一分期的患者,也有了更多、更有效的治疗选择,这反过来也要求分期必须更加精确以匹配最佳疗法。
“最佳手术候选者”和“无法切除”的中期患者这两个概念与这一定义相符。肝切除的最佳手术适应症取决于多参数评估,其中包括剩余肝脏功能评估、门静脉高压程度、剩余肝实质体积以及采用腹腔镜/微创手术的可能性。【EASL 2018 Giannini EG, 2019 Vitale A, 2019】(3,4,34)超越最初的单参数 BCLC 模型(将单一变量作为手术的绝对禁忌症),显然为从右向左的治疗阶段迁移提供了更大的便利。此外,“最佳手术候选者”的定义不再阻止“次优”病例接受 肝切除,只要他们符合术后死亡率和发病率风险可接受的类别,并且与替代方案相比,LR 预期能带来生存获益。【Vitale A, 2019】(34)同样,“无法切除”的中期患者这一定义明确表明,对于某些此类病例,肝切除术可能被视为一种选择(可能是首选)。
由于从左至右(即从根治性治疗到姑息性治疗)肝细胞癌(HCC)治疗方案的假定疗效逐渐降低,因此在不同阶段之间认可双向治疗迁移,显然是承认 BCLC 方案所推荐的一线治疗对于某些患者而言可能属于“过度治疗”,而对于另一些患者则属于“治疗不足”。
因此,“治疗阶段迁移”代表了一种调整,旨在缩小实际临床需求与僵化且有时不恰当的治疗决策之间的差距。然而,它仍保持了“分期决定”而非“患者定制”的肝癌管理理念,这种理念贯穿于 BCLC 系统的核心思想,即根据特定治疗可能取得最佳结果的最高概率对患者进行分组,而非为个体患者选择最佳治疗方案。这或许可以解释为何在该策略的定义中存在明显的倾向,即优先考虑从左向右的迁移。“治疗阶段迁移”因此可以被视为一种基于“分期层级”这一概念性构想的策略(下图 )。
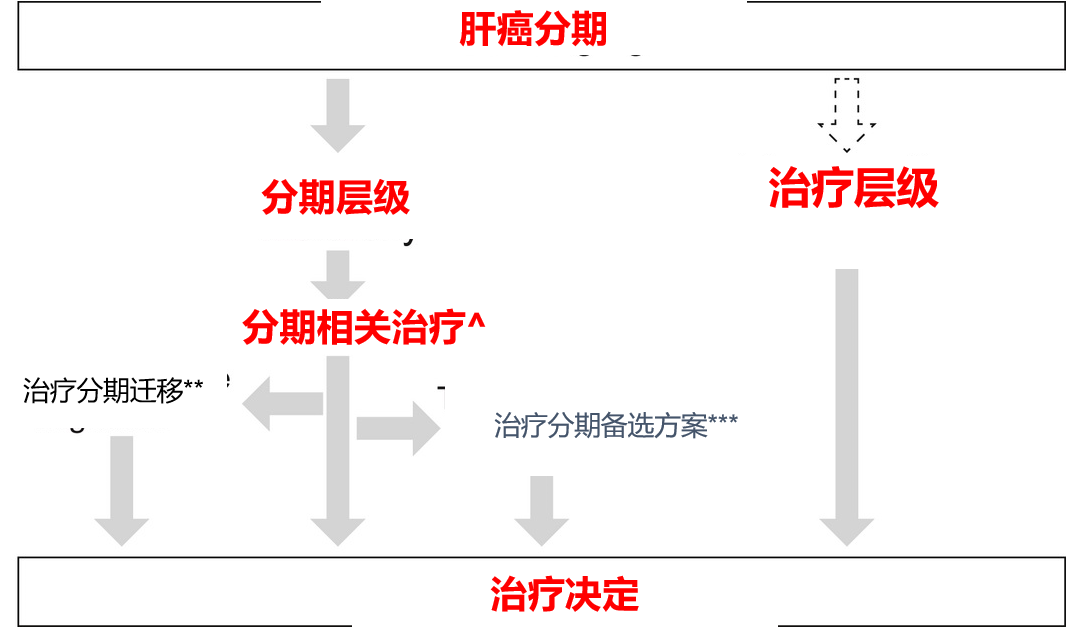
最后,在评估“治疗阶段迁移”的实际效用时,应当承认 BCLC B 期和 C 期的过度异质性【Park JW, 2015 Pecorelli A, 2017 Bolondi L, 2012】(23,29,35),这使得这种做法得以相当频繁地应用,从而混淆了原 BCLC 模型作为当代肝细胞癌管理中有效治疗指导起点的作用。