非食道静脉曲张消化道出血的血管内治疗围手术期相关并发症发生率大约在10%左右,包括血管造影相关并发症、血管收缩剂使用相关并发症和栓塞相关并发症和死亡。临床相关的患者基本条件如年龄和伴发疾病与围手术期相关并发症强烈相关;而操作相关围手术期并发症包括与临床结果无关的并发症和急性肠缺血并发症(<5%)。
1. 血管造影相关并发症
(1)穿刺部位相关并发症 ( Puncture site complications )
(2)CIN -造影剂肾病(Contrast-induced nephropathy:此病人人群较高
(3)其它全身并发症:心肌缺血、败血症和过敏反应
2. 血管收缩剂使用相关并发症:
心律失常、血栓,心肌缺血,体液潴留(fluid retension)
3. 栓塞相关并发症[6,8]
(1)肠道缺血(Bowel ischemia )/梗死:
发生率0-4%;下消化道出血>上消化道出血;微粒>明胶海绵颗粒>弹簧栓子;缺血性改变大多数是自限性的。肠梗塞[5] :9%。
究竟栓塞几支从边缘动脉发出的直小动脉是可以接受的,但断不能拿人进行实验,所以本文是一篇关于实验研究的论文,旨在评估通过选择性栓塞上腔肠动脉(SMA)分支(在vasa recta水平)使用N-丁基氰丙烯酸酯(NBCA)后,小肠缺血变化的程度。研究对象为六只狗,通过栓塞不同数量的vasa recta分支,并在栓塞后24小时处死动物,以观察和比较不同栓塞程度对小肠组织的影响。
研究目的
评估小肠缺血变化:研究通过选择性栓塞SMA分支(vasa recta水平)使用NBCA后,小肠缺血变化的程度。
材料与方法
实验对象:六只狗。
栓塞操作:在五支独立的SMA分支(vasa recta水平)中进行选择性栓塞,使用NBCA。
分组标准:
组A:栓塞三支或更少的asa recta。
组B:栓塞四支或更多的 vasa recta。
时间点:所有狗在栓塞后24小时被处死。
组织学评价:由病理学家对栓塞段的粘膜层、粘膜下层和肌肉层进行组织学评价。
结果
组A(n=15):
正常发现:7个段(47%)正常。
轻度缺血变化:
粘膜层:8个段。
粘膜下层:4个段。
肌肉层:1个段。
组B(n=15):
缺血变化:
粘膜层:所有15个段。
粘膜下层:14个段。
肌肉层:10个段。
统计差异:组A和组B之间的缺血损伤差异具有统计学意义。
结论
栓塞影响:
三支或更少vasa recta:相对可耐受。
四支或更多vasa recta:增加显著小肠缺血损伤的风险。
进一步研究:需要进一步的研究来确定这些发现对人体的临床意义。
总结
本文通过实验研究了选择性栓塞上腔肠动脉(SMA)分支(vasa recta水平)使用N-丁基氰丙烯酸酯(NBCA)后,小肠缺血变化的程度。研究发现,栓塞三支或更少的vasa recta对小肠的影响较小,而栓塞四支或更多的vasa recta则可能导致显著的小肠缺血损伤。这一发现对于理解该手术技术的安全性和潜在风险具有重要意义,但作者也指出,需要进一步的研究来验证这些发现是否适用于人类患者。核心观点是,选择性栓塞的数量直接影响小肠的缺血损伤程度,临床上应谨慎考虑栓塞的范围。

本文是一篇回顾性研究,旨在评估使用N-丁基氰丙烯酸酯(NBCA)进行经导管动脉栓塞术(TAE)控制急性下消化道出血的安全性和风险。研究通过血管造影和结肠镜检查来评价这一治疗方法的效果,并探讨不同栓塞策略下的并发症情况。
研究目的
材料与方法
结果
-
手术成功率:所有患者均成功进行了手术。
-
缺血性变化:
-
并发症处理:
-
组Ib:缺血性并发症在未治疗的情况下自行缓解。
-
组II:
结论
总结
文章通过回顾性分析16例使用NBCA进行TAE治疗急性下消化道出血的病例,评估了该方法的安全性和风险。研究发现,栓塞过多的直肠侧支血管(≥3支)容易导致需要治疗的肠缺血损伤,而栓塞单个直肠侧支血管但≥2支分支虽然也会引起缺血性并发症,但这些并发症通常较轻且可以自行缓解。因此,选择合适的栓塞策略对于减少并发症至关重要。核心观点是,NBCA TAE在控制急性下消化道出血方面具有一定的安全性和有效性,但需谨慎选择栓塞范围以避免严重并发症。
(2)意外栓塞:(?%)但罕见
女,74岁 多种疾病和间歇性消化道出血,红细胞标记扫描出血部位被定位在右下腹,回场末段或升结肠。早先血管造影和内视镜为阴性。两天后再次大出血。
Onyx 胶非靶血管栓塞
 |
 |
|
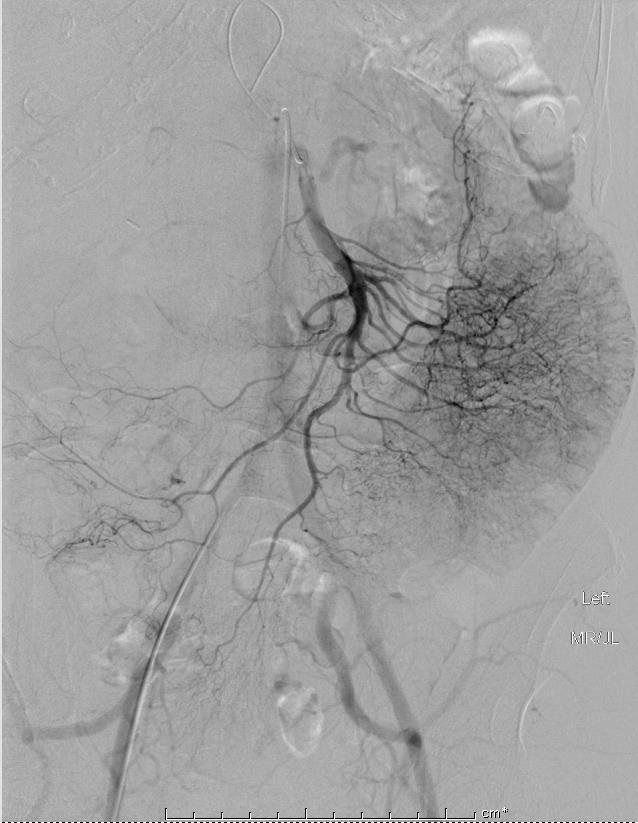
选择性肠系膜上动脉造影发现造影剂外溢,在结肠的起始部位 |
选择性肠系膜上动脉造影发现造影剂外溢 |
 |
 |
|
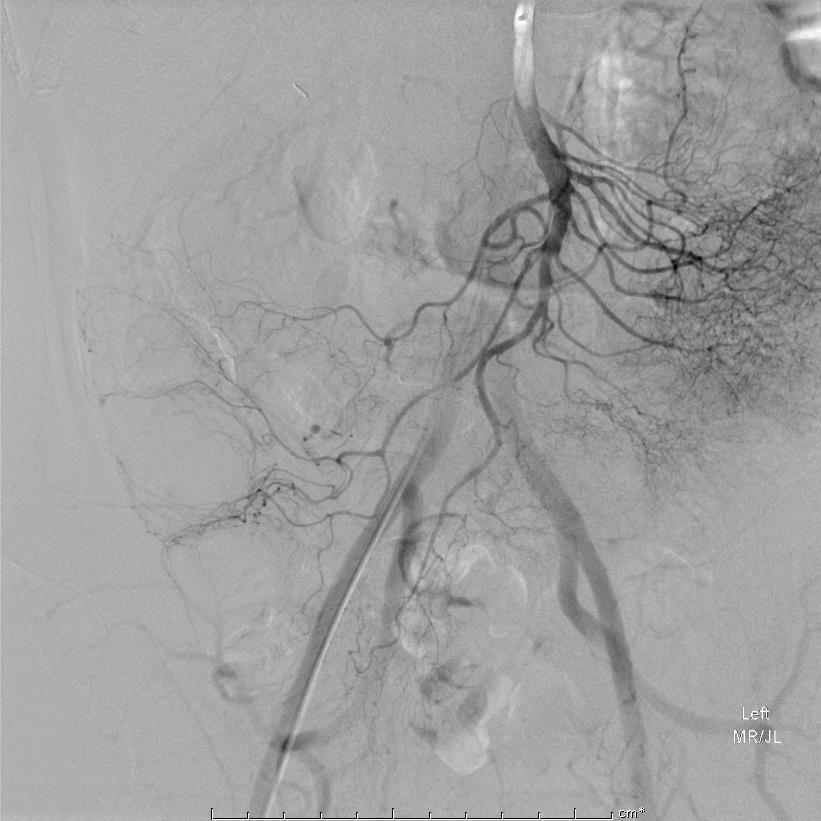
选择性回盲动脉造影证实选择性肠系膜上动脉造影进一步证实出血 |
在超选择造影病变更清晰 |
 |
 |
|
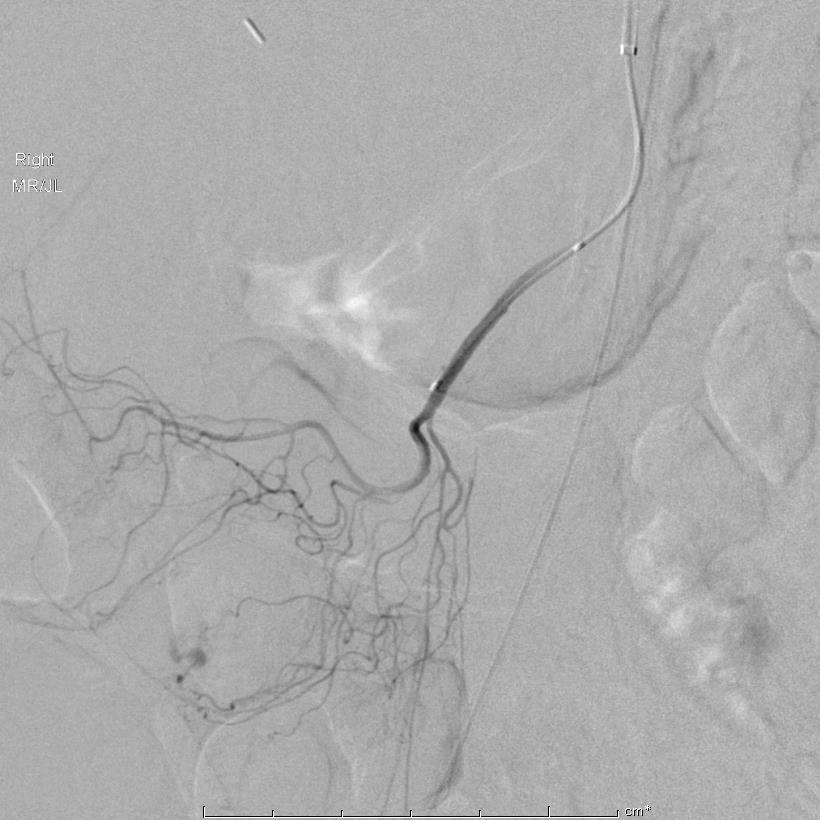
经微导管注射Onyx 18 |
Onyx 18 注射 |
 |
 |
|
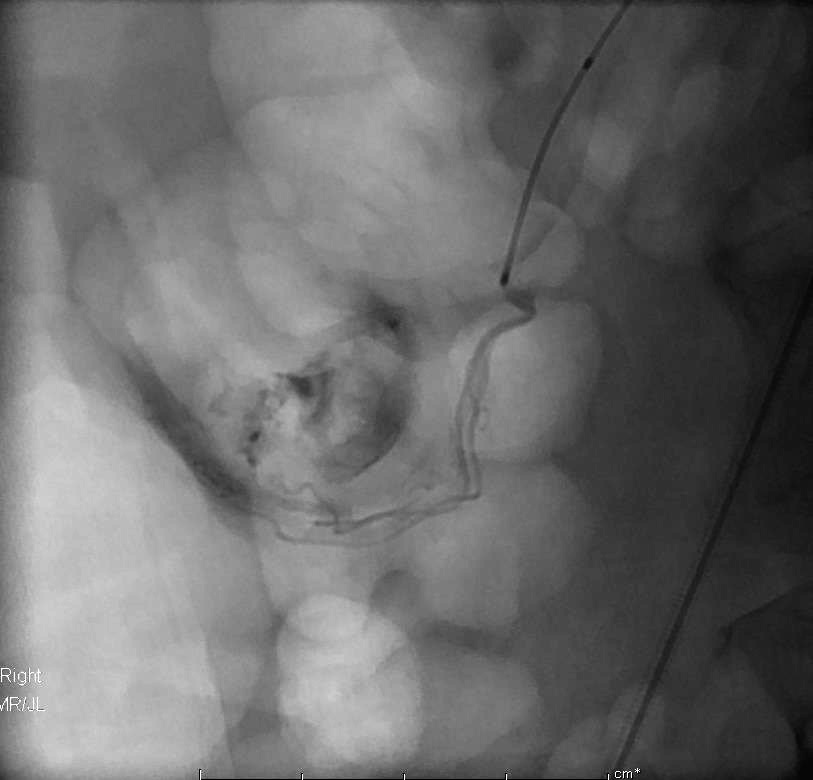
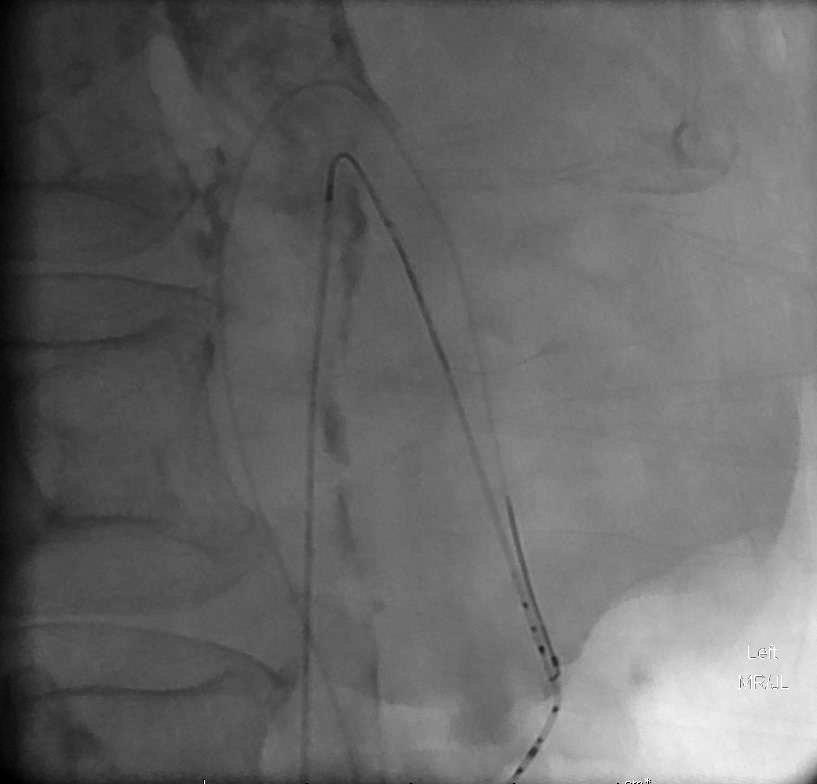
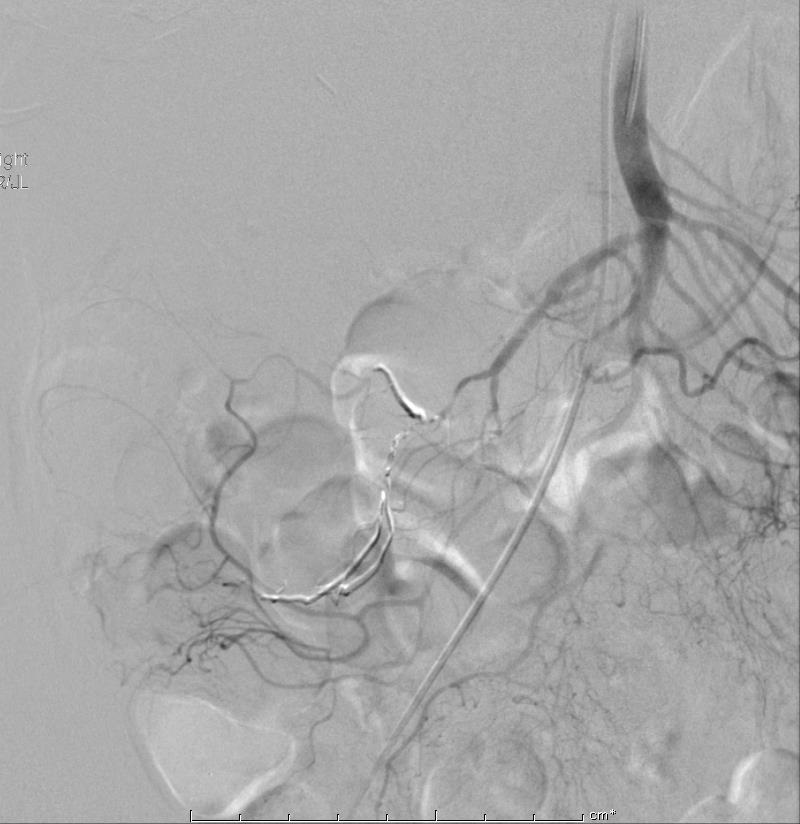
胶返流到上一级血管,而微导管被粘在血管内。在试图后撤时,微导管和血管造影导管的关系变成这个样子 |
普通血管造影管被撤出(需要在体外剪断微导管才能撤出),经剪断的微导管置入微导丝(不然不够置换的长度),换8F的鞘,置入8F引导导管,在导丝引导下肾动脉引导导管进入肠系膜上动脉开口 |
 |
 |
|
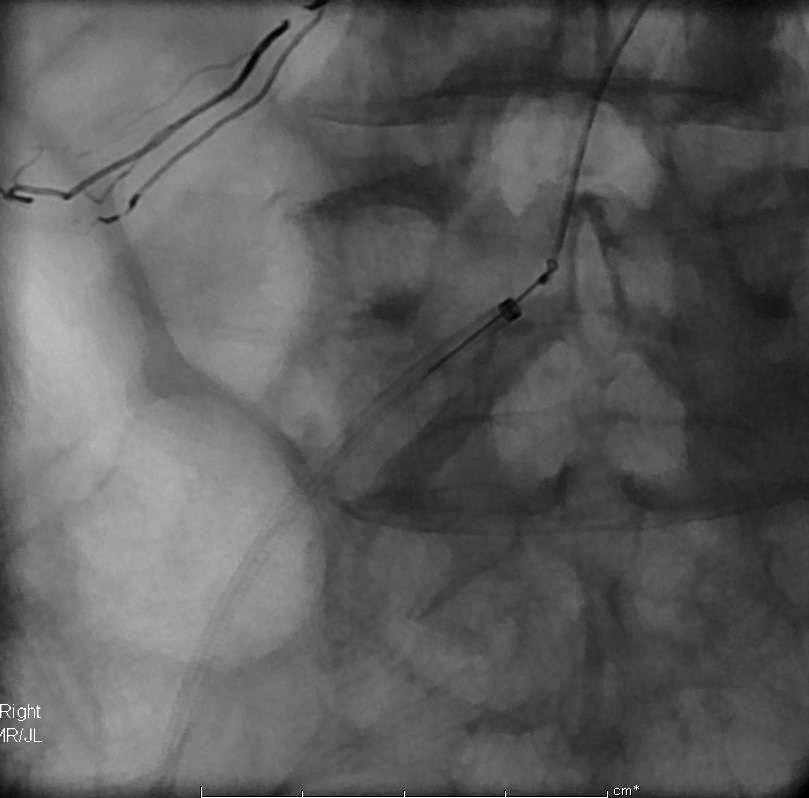
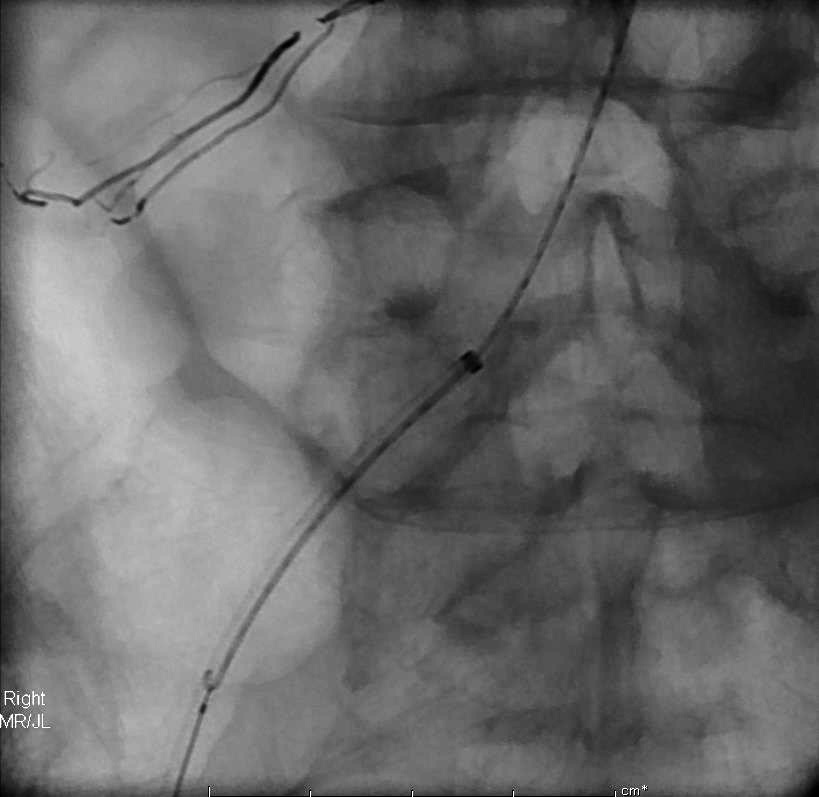
在体外事前将圈套器套入微导管的断端,使微导管始终保持在圈套器内。圈套器圈在引导导管内沿微导管上行。套器过来啦, |
拉吧! |
 |
 |
|
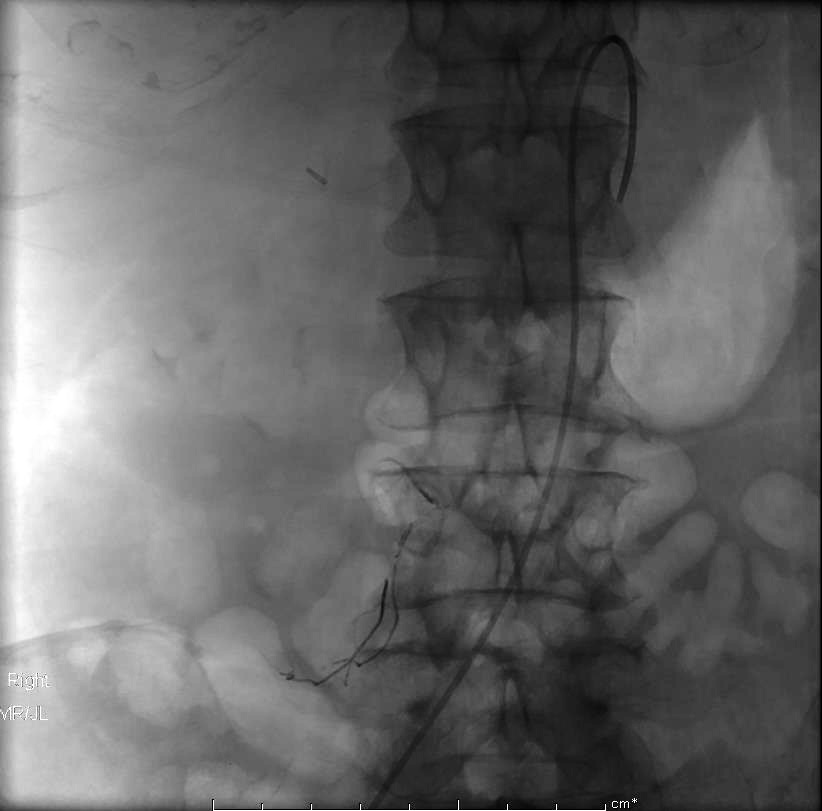
接着拉! |
出来了,血管造影导管进入SMA |
 |
|
最后结果,出血停止。病人稳定,没有缺血体征。但24小时后的内窥镜的随访显示相应部位缺血的粘膜。 |
(3)弹簧栓子释放位置不良或移位(1-3%)。
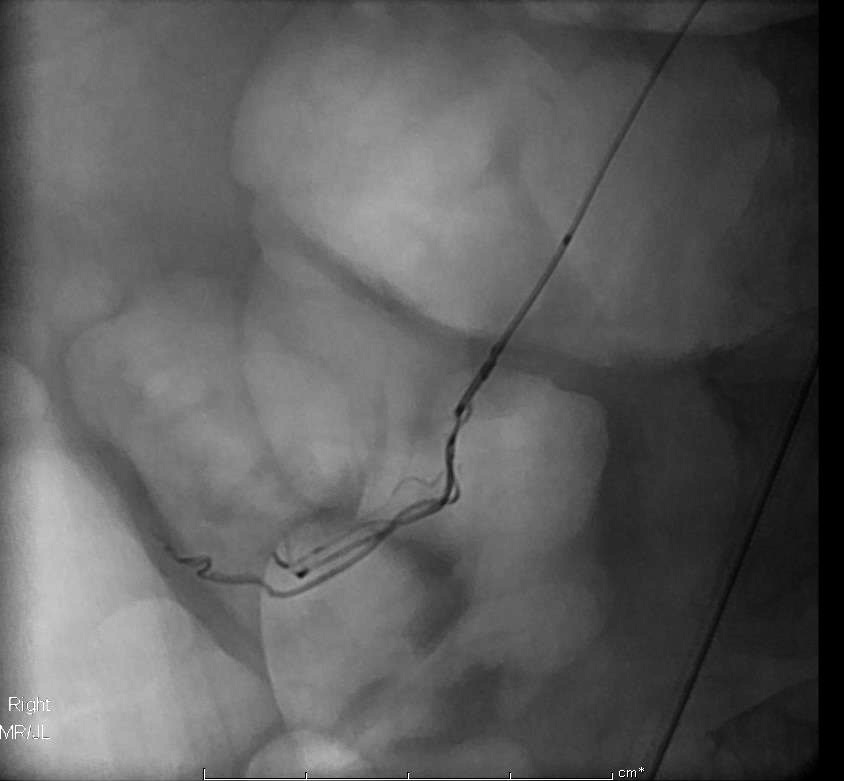
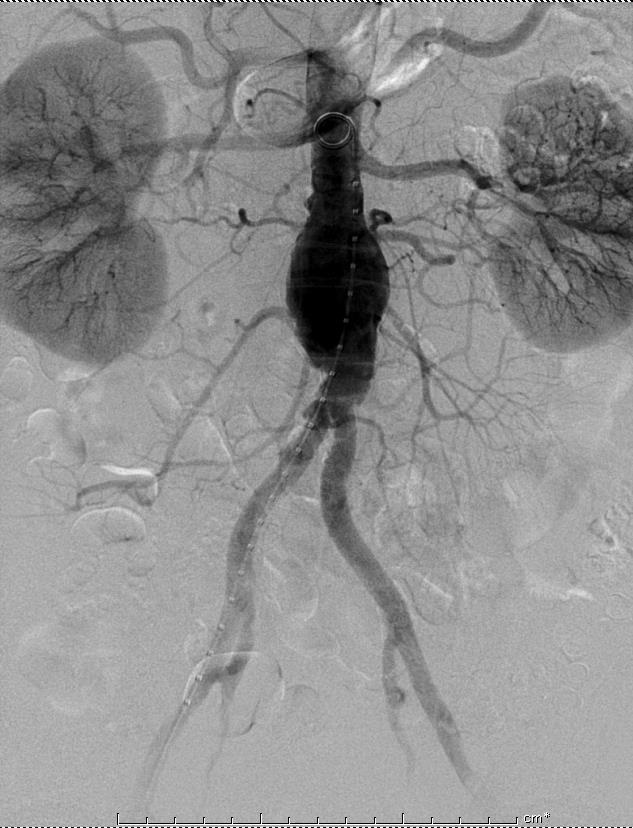
腹主动脉瘤血管移植物前,发现肠系膜下动脉开放。预防性肠系膜下动脉栓塞
 |
 |
|
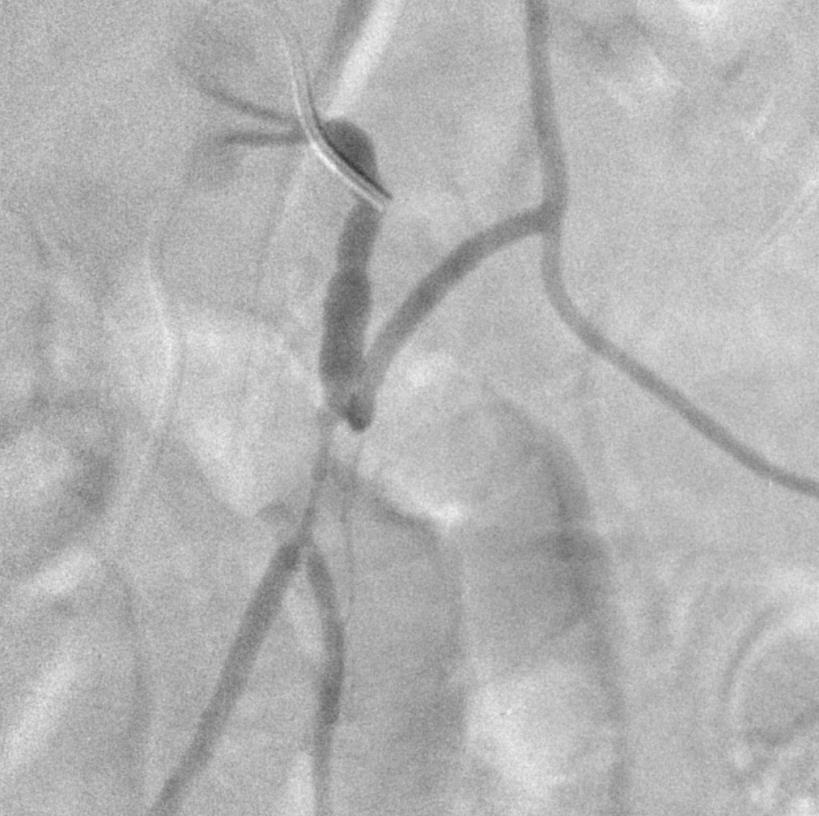
腹主动脉瘤,造影发现开放的肠系膜下动脉 |
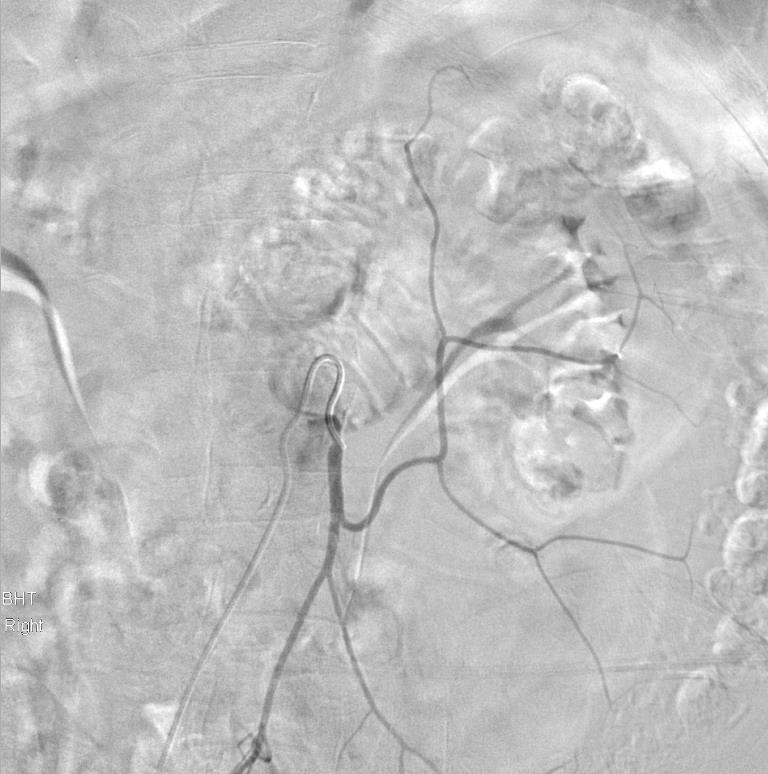
选择性肠系膜下动脉造影显示其开放 |
 |
 |
|
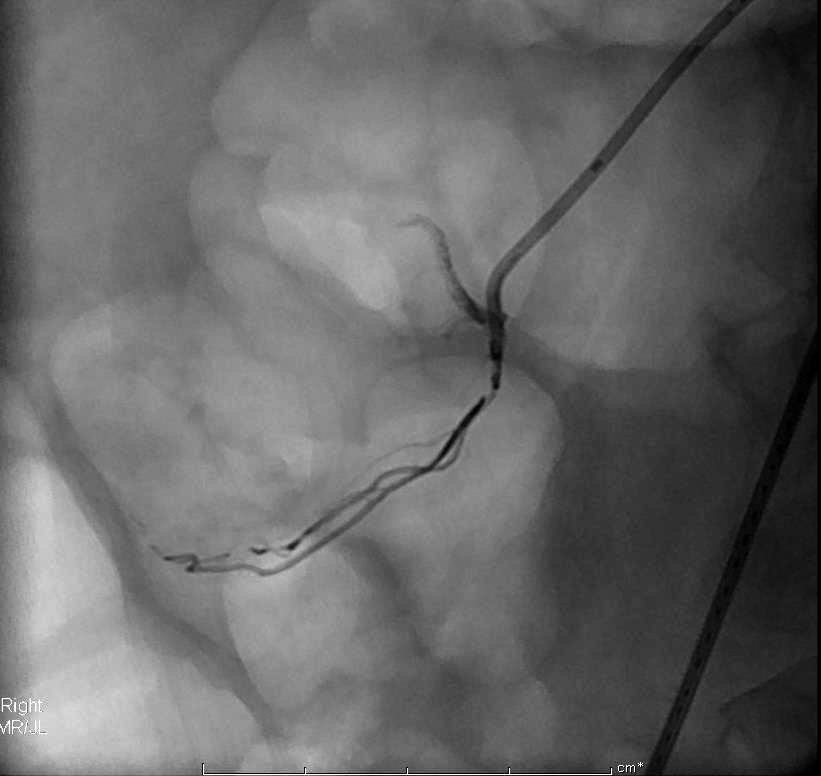
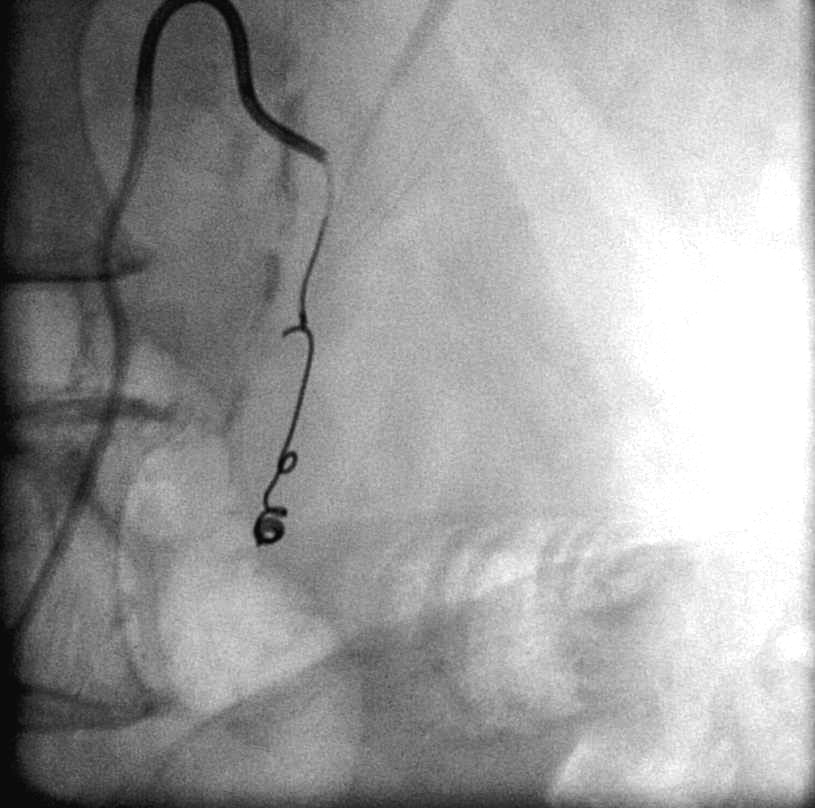
微弹簧栓子释放显示位置不良。主要由于弹簧栓子的成篮直径过大。 |
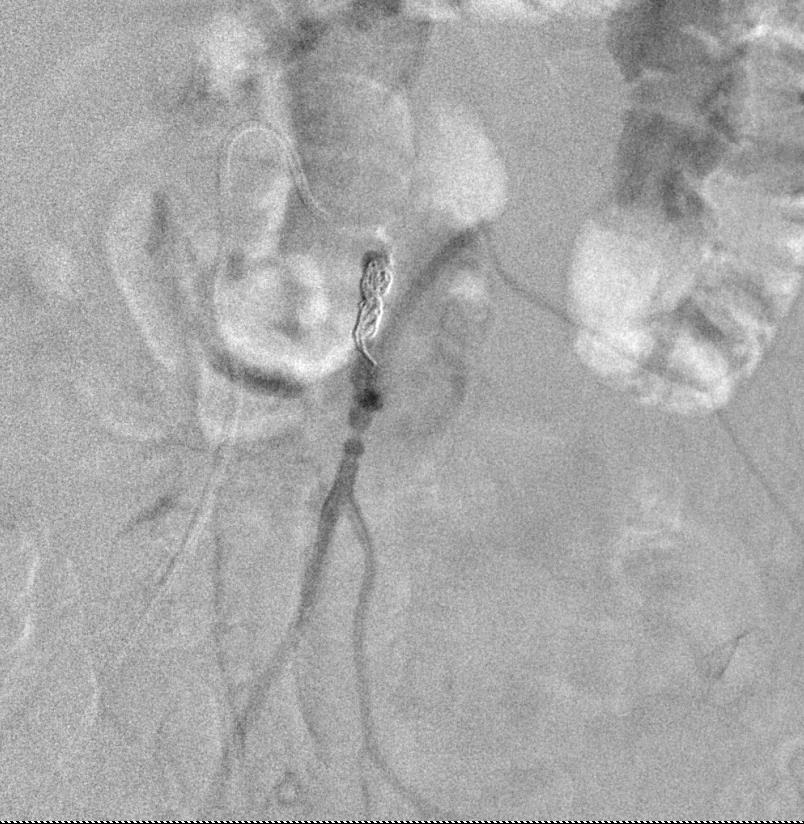
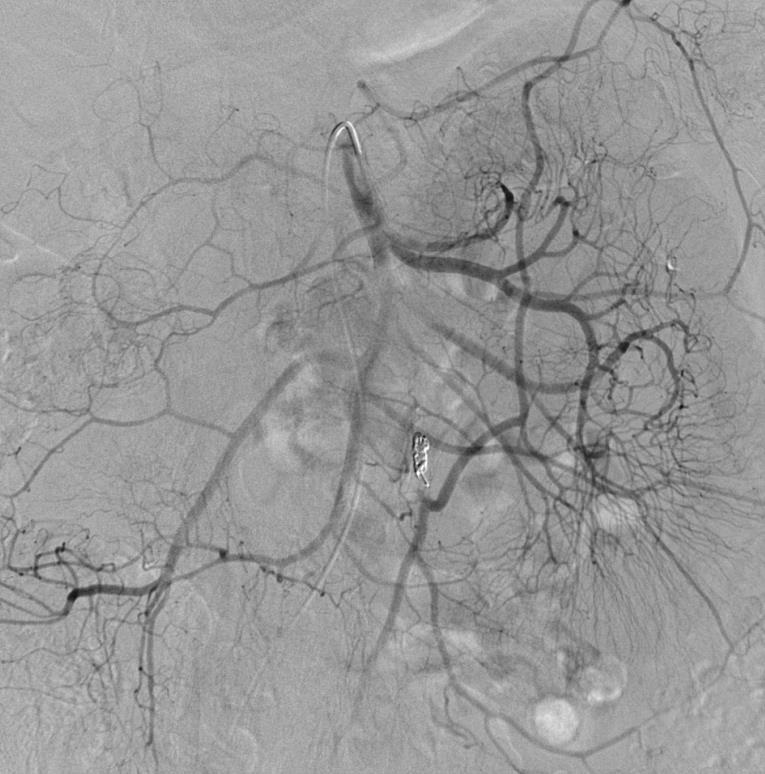
取出后重新置放,远端痉挛被发现 |
 |
 |
|
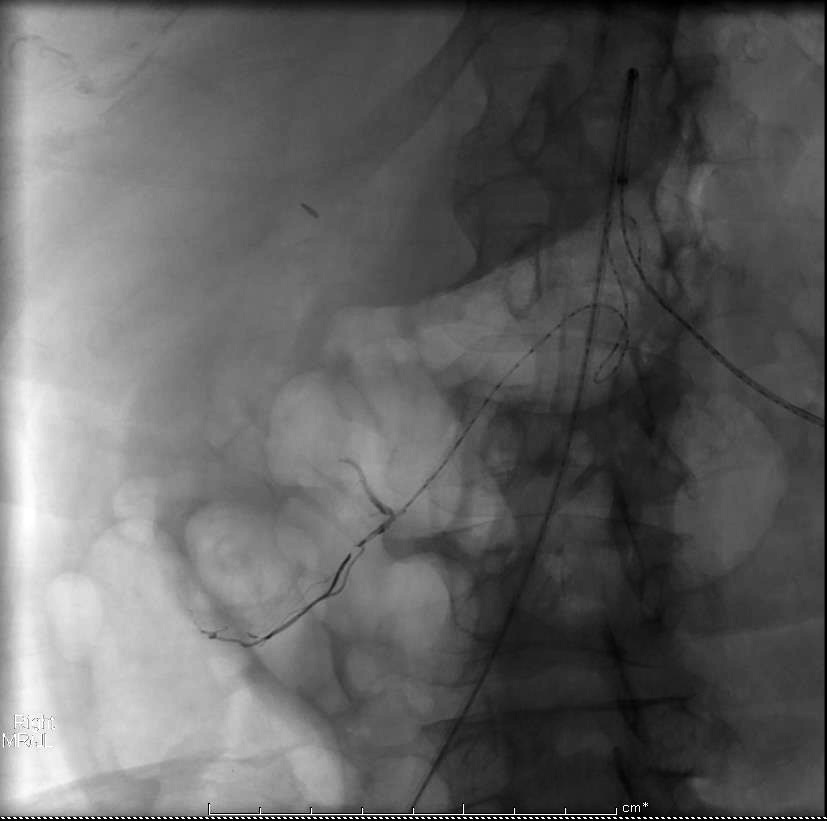
取出后重新置放 |
肠系膜上动脉造影显示,栓塞远端肠系膜下动脉供血由边缘动脉参与。 |
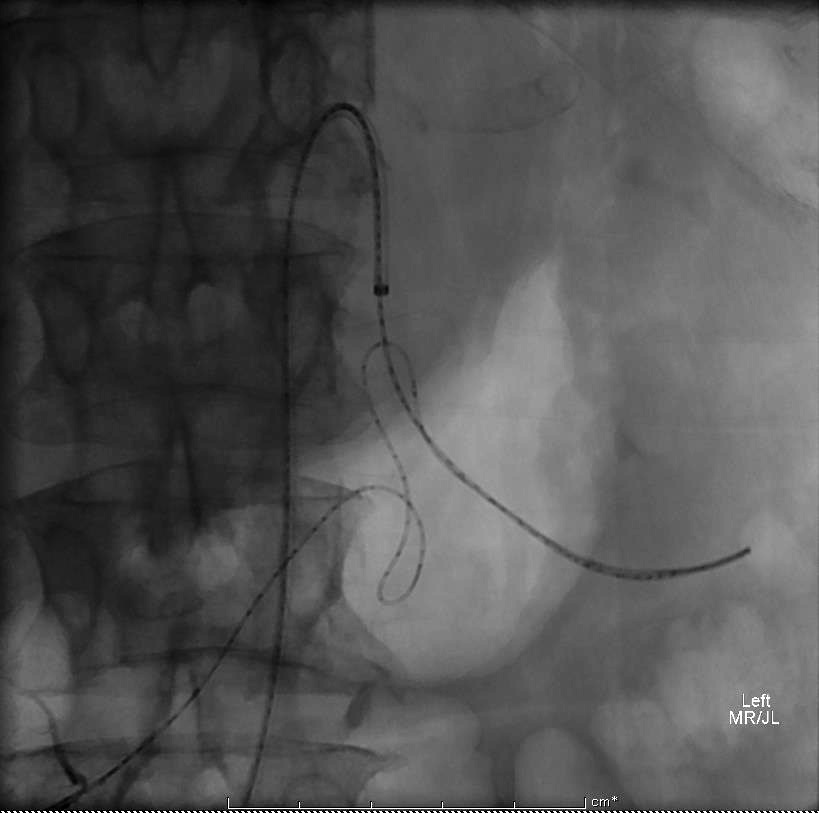
预防推式弹簧栓子释放时位置不良可选择正确直径大小或使用可脱微弹簧栓子。
(4)痉挛/夹层(2%)
(5)导管相关血栓形成(罕见)
4. 再出血
出血部位血管丰富(abundant vascular supply),缺血并发症的几率低,但潜在持续性或复发出血的几率高。上消化道出血栓塞后的再出血率为27% [1-3]。而外科术后消化道出血的再发生率也是27%。栓塞后30天再出血率为23%-45%,特别是经验性栓塞(血管造影并没有发现出血源)。上消化道出血栓塞后再出血的预测因子,临床相关最强因子是凝血障碍,操作相关的最强因子是单独使用弹簧栓子[6]。
Loffroy 等人曾综合复习了消化道出血栓塞相关并发症之再出血
消化道出血栓塞并发症
|
文献/年 |
例数 |
与再出血相关的单因素分析(p<0.05) |
与再出血相关的多因素分析(p<0.05) |
|
Encarnacion/1995 |
29 |
- 凝血功能障碍 |
- 凝血功能障碍 |
|
Walsh/1999 |
50 |
- 手术操作时间较长
- 输血较多
- 外科手术史 |
- 操作时间过长
- 输血较多
- 外科手术史 |
|
Schenker/2001 |
163 |
NA |
- 多系统衰竭
- 凝血功能障碍
- 继发于创伤的出血或微创手术后的出血 |
|
Defreyne/2001 |
20 |
- 失血(Hg <80g/L)
- 低容量性休克
- 糖皮质激素的应用
- 操作前前输血较多
- 操作前前新鲜冻干血浆输入较多 |
NA |
|
Aina/2001 |
75 |
- 凝血功能障碍
- 有肝硬化 |
- 凝血功能障碍
- 仅使用弹簧栓子栓塞 |
|
Poultsides/2008 |
57 |
- 操作前输血超过6单位 |
- 操作前多于6个单位输血
- 以前存在十二指肠溃疡的缝合结扎 |
|
Loffroy/2009 |
60 |
- 凝血功能障碍
- ≥2合并疾病
- 术前前休克时间较长
- 术前输血较多
- 弹簧栓子作为唯一的栓塞剂使用 |
凝血功能障碍
- 弹簧栓子是唯一的栓子 |
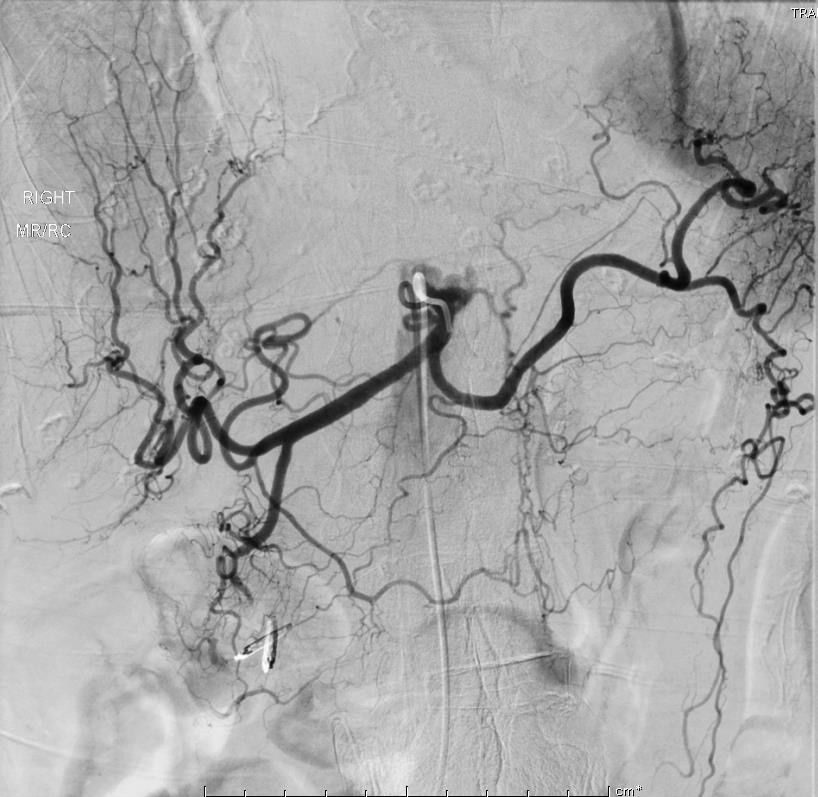
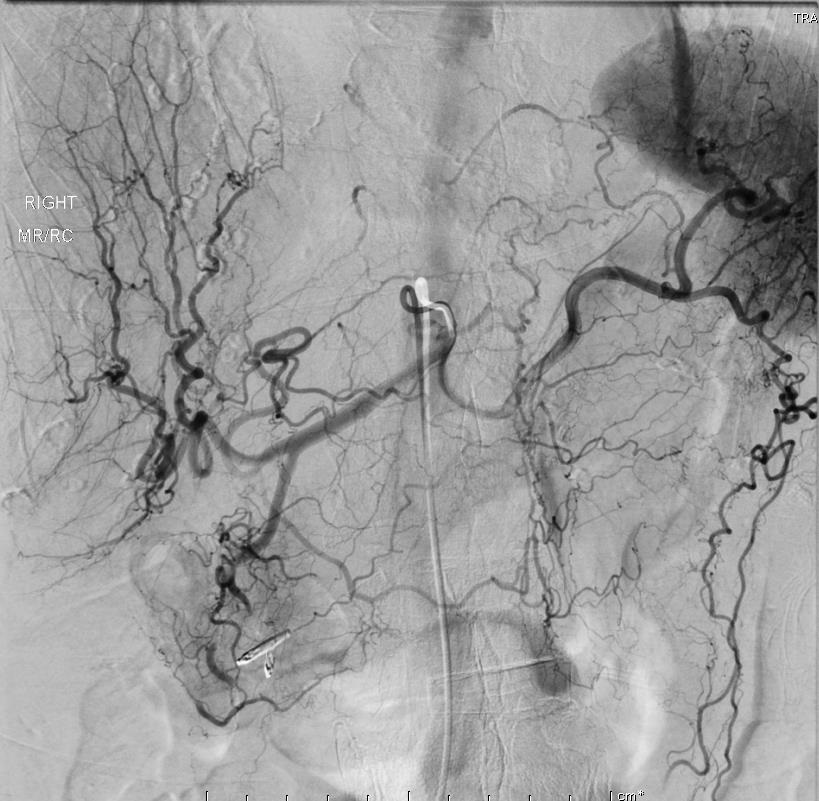
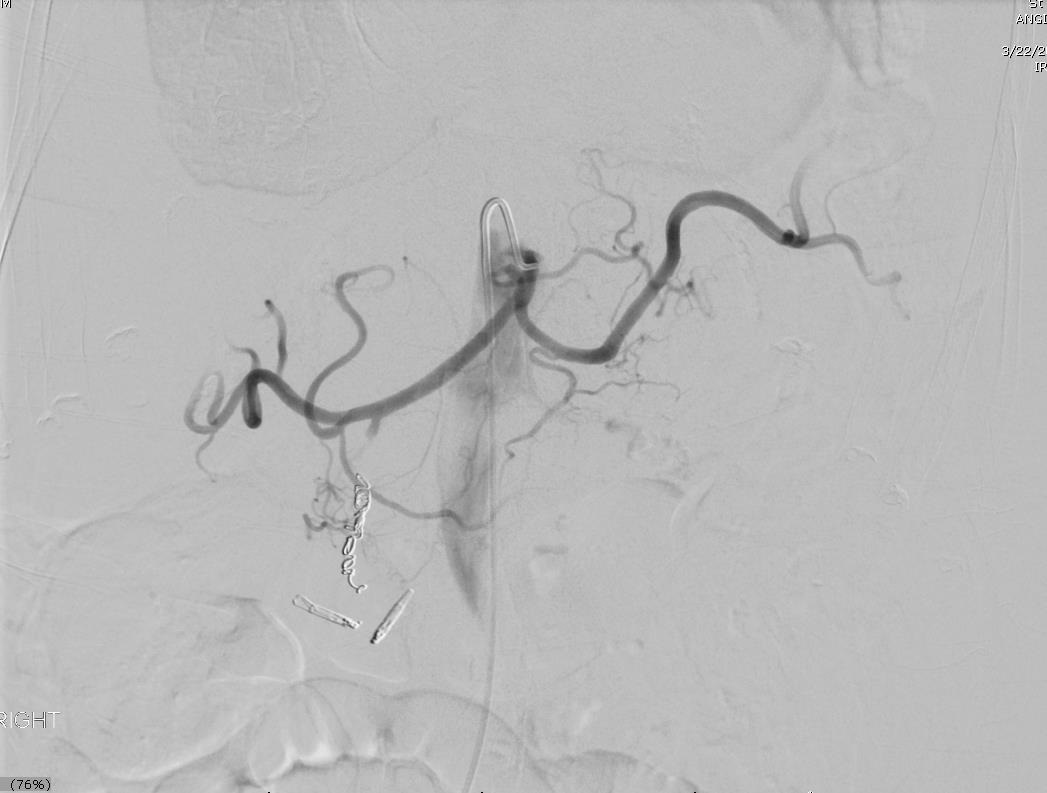
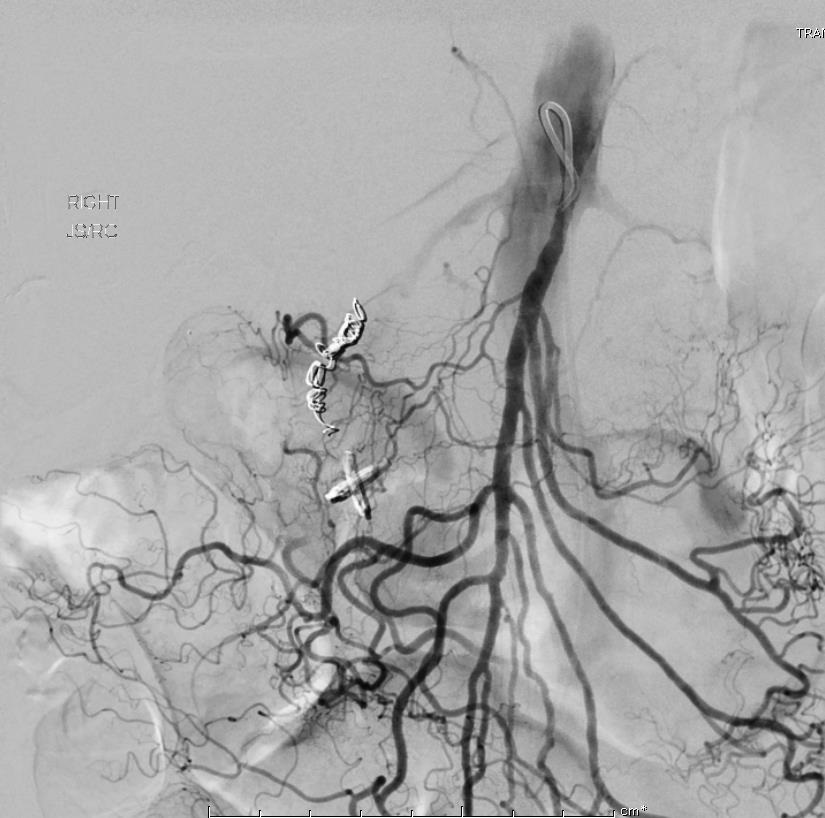
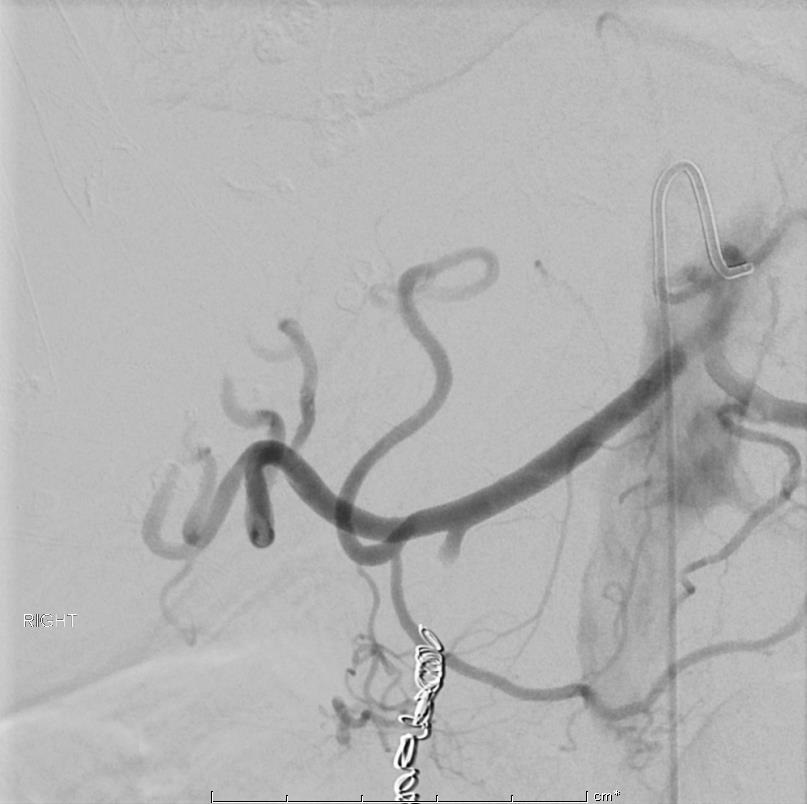
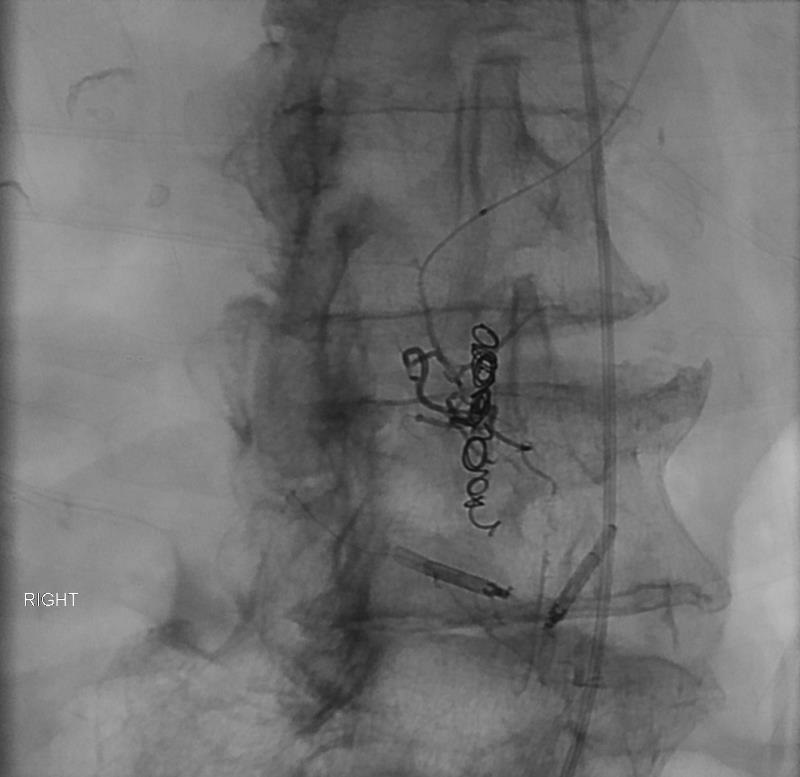
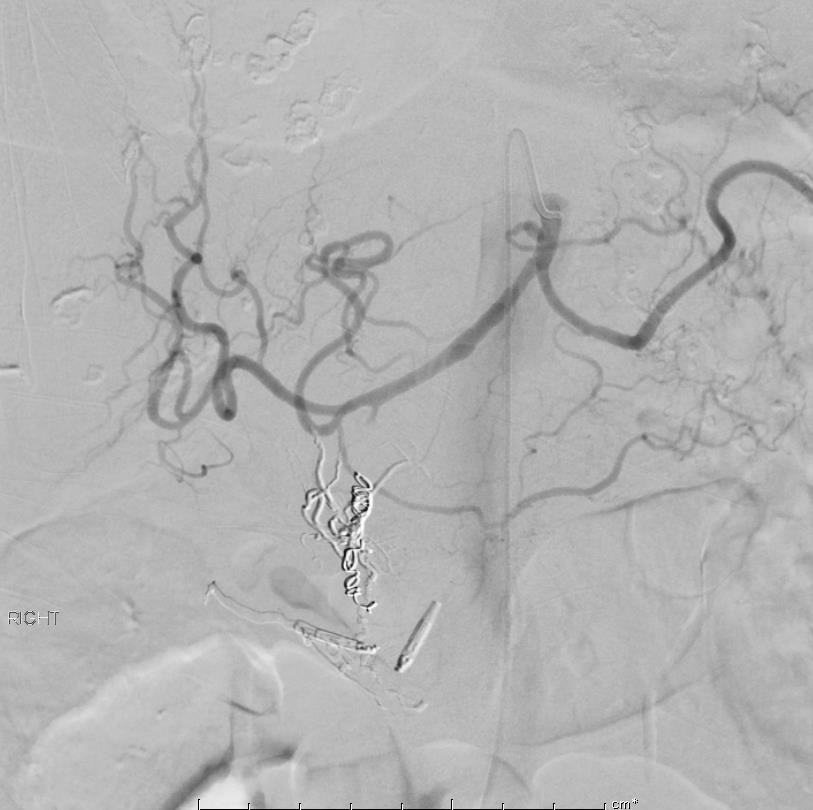
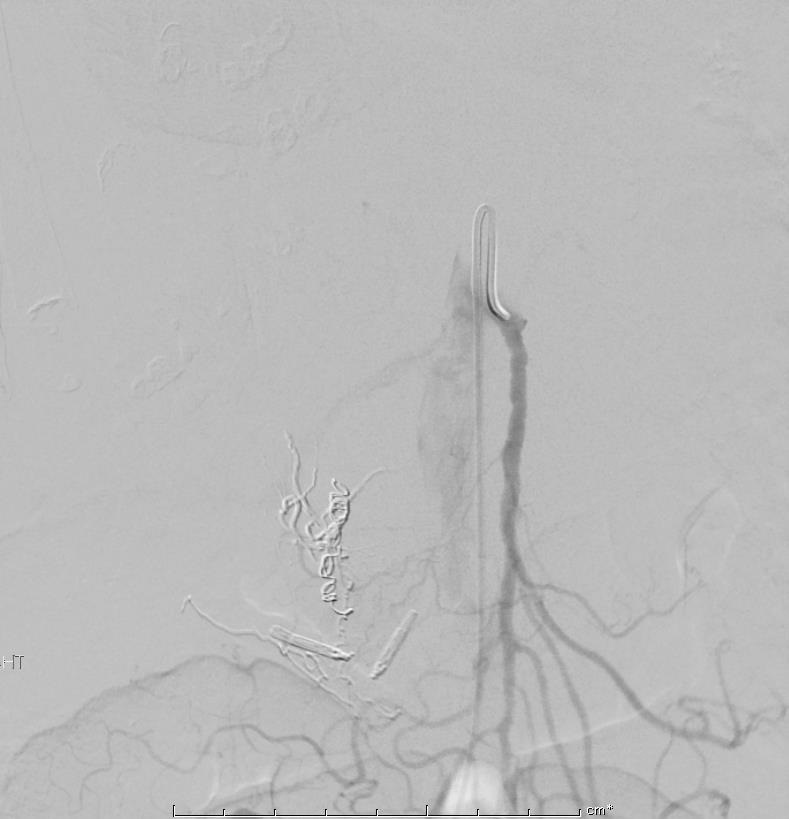
86F 间断消化道出血,需输血治疗。内窥镜12指肠溃疡治疗失败
 |
 |
 |
 |
 |
 |
 |
 |
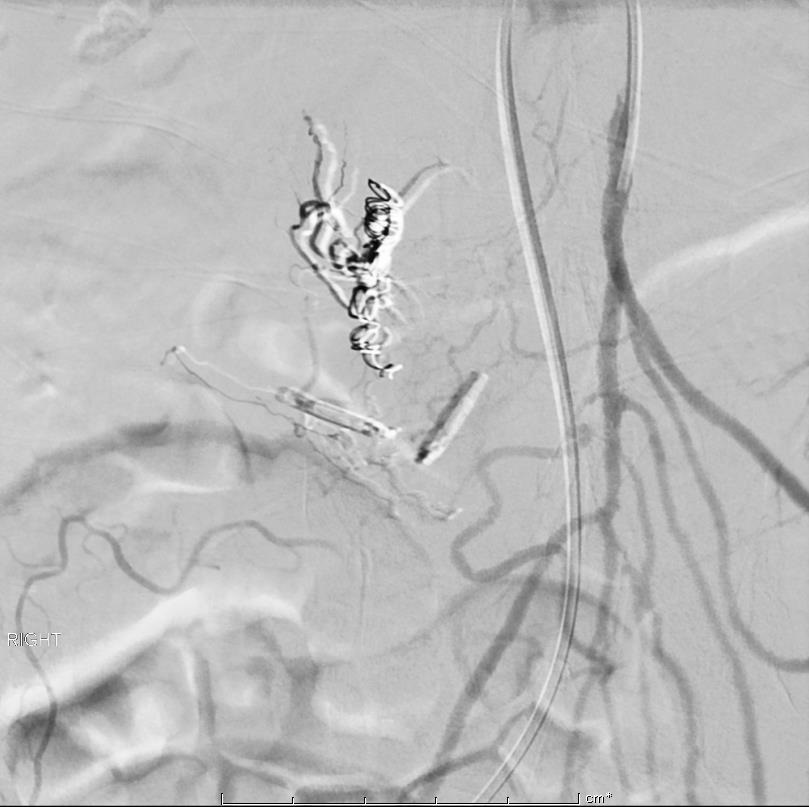 |
反复栓塞仍然间歇性出血。
5. 死亡[6,7]
(1)30天死亡率9%-31%
(2)相关操作死亡率<5%
结论:血管内治疗消化道出血的并发症有多种,但发生率少见。也是可预防和处理的。

急性下消化道出血(LGI),即Treitz韧带远端的出血,在临床治疗上存在挑战,有一定的治疗缺口。本次研究的目的是评估超选择性栓塞治疗急性下消化道出血(LGI)的疗效。
2007年6 - 8月,对20例急性LGI出血患者进行了经导管超选择性动脉栓塞(TAE)治疗。所有患者均使用微导管,使用的栓塞剂包括微弹簧栓子(16例)、聚乙烯醇(PVA)颗粒(2例)以及微弹簧栓子和PVA颗粒联合使用(2例)。主要结局指标为技术成功(血管造影完成时记录的出血完全停止)、临床成功(TAE后30天内LGI出血的体征或症状消失)以及主要和次要并发症发生率。
:技术成功率达到100%,即所有患者的活动性出血都得到了有效控制;临床成功率为90%(20例患者中有18例)。
:主要并发症包括TAE后第3周因肺栓塞、心肌梗死和多器官衰竭导致的3例死亡,以及1例与手术相关的结肠梗死;次要并发症为1例患者出现腹股沟血肿。
初步研究显示,超选择性栓塞可作为急性LGI出血的有效微创控制手段,但该方法伴随着严重并发症风险。由于样本量仅20例且为2007年单中心数据,现代栓塞材料或许可以降低并发症率。
1. Ripoll C, Banares R, Beceiro I, et al. Comparison of transcatheter arterial embolisation and surgery for treatment of bleeding peptic ulcer after endoscopic treatment failure. J Vasc Interv Radiol 2004;15:
2. Defreyne L, De Schrijver I, Decruyenaere J, et al. Therapeutic decisionmaking in endoscopically unmanageable nonvariceal upper gastrointestinal hemorrhage. Cardiovasc Intervent Radiol 2008;31:897-905.
3. Eriksson LG, Ljungdahl M, Sundbom M, et al. Transcatheter arterial embolisation versus surgery in the treatment of upper gastrointestinal
bleeding after therapeutic endoscopy failure. J Vasc Interv Radiol 2008; 19:1413-8
4. S. Mirsadraee , P. Tirukonda , A. Nicholson , S.M. Everett , S.J. McPherson Embolization for non-variceal upper gastrointestinal tract haemorrhage: A systematic review. clinical Radiology 2011 Jun;66(6):500-9.
5. Lang EK. Transcatheter embolisation in management of hemorrhage from duodenal ulcer: long-term results and complications. Radiology 1992 1992 Mar;182(3):703-7.
6. Yap FY, Omene BO, Patel MN, Yohannan T, Minocha J, Knuttinen MG, Owens CA, Bui JT, Gaba RC. Transcatheter embolotherapy for gastrointestinal bleeding: a single center review of safety, efficacy, and clinical outcomes. Dig Dis Sci. 2013 Jul;58(7):1976-84.
7. Tan KK, Wong D, Sim R. Superselective embolization for lower gastrointestinal hemorrhage: an institutional review over 7 years. World J Surg. 2008 Dec;32(12):2707-15
8. Walker TG. Acute gastrointestinal hemorrhage. Tech Vasc Interv Radiol. 2009 Jun;12(2):80-91.
| 