全球肝癌流行病学的趋势对肝癌的筛查、预防和治疗有着实际意义。肝细胞癌(HCC)的死亡率在全球范围内呈上升趋势,尤其是在西方世界。
肝硬化仍是 HCC 的主要危险因素。然而,HCC 发病率从病毒相关肝病患者向酒精相关和代谢功能障碍相关脂肪肝等非病毒病因患者的转变,对预防、监测和治疗具有重要影响。
乙肝疫苗接种和乙肝、丙肝的抗病毒治疗对病毒相关 HCC 的一级预防有效,但针对非病毒性肝病的化学预防策略仍是一大未满足的需求。
新出现的数据表明阿司匹林、他汀类药物、二甲双胍和咖啡与 HCC 发病率降低有关,尽管尚未证明其具有因果关系。通过半年一次的监测进行 HCC 的二级预防与早期发现率提高以及死亡率降低相关;
然而,包括腹部超声在内的现有工具对早期 HCC 的检测灵敏度欠佳,尤其是在肥胖和/或非病毒性肝病患者中。尽管基于血液或影像学的监测策略前景可期,但这些方法在临床实践中应用之前仍需进一步验证。
在此期间,应致力于最大限度地利用现有的监测工具,因为这些工具在全球范围内普遍使用不足。在肝细胞癌(HCC)的治疗方面已取得了显著进展,包括扩大手术治疗的适用范围、改进局部区域治疗的患者选择以及增加全身治疗方案,包括免疫检查点抑制剂。在本栏目中,我们将讨论 HCC 流行病学的趋势及其对筛查、预防和治疗的影响。
关键要点
肝细胞癌(HCC)的风险因素已发生流行病学转变,从病毒相关因素转变为非病毒性肝病,包括酒精相关和代谢功能障碍相关的脂肪性肝病。
尽管针对病毒相关肝硬化和肝细胞癌(HCC)的一级预防已有有效的干预措施,但对于非病毒性肝病的化学预防仍是一大未被满足的需求。
通过每半年一次基于超声检查对肝硬化患者进行监测的二级预防措施,与提高肝细胞癌(HCC)的早期检出率以及降低 HCC 相关死亡率有关;然而,目前的工具在检测肥胖和/或非病毒性肝病患者的早期 HCC 方面灵敏度较低。
此外,在临床实践中,肝细胞癌(HCC)的监测未得到充分利用,尤其是在患有非病毒性肝病的患者以及在胃肠病学和/或肝病学专科之外接受随访的患者中,这凸显了需要采取多层次的干预措施来提高其使用率。
在治疗方面取得了巨大的进展,包括扩大了手术治疗的适用范围,改进了局部区域治疗的患者选择标准,以及增加了全身治疗的选择。
免疫检查点抑制剂彻底改变了肝细胞癌(HCC)的治疗格局,无论是晚期肝细胞癌患者还是早期肝细胞癌患者均从中受益。
肝癌是全球第六大常见癌症,也是癌症相关死亡的第三大原因,2020 年新增病例超过 90 万例,死亡病例超过 83 万例【Sung H 2021】。肝细胞癌(HCC)占肝癌的 80%以上,在 46 个国家中是癌症相关死亡的前三大原因,在 90 个国家中是前五大原因 【Rumgay, H 2022】。过去几十年来,许多国家的 HCC 发病率有所下降,但在其他地区却在上升【Liu, Y 2022】,本栏目后面会对此进行更详细的讨论。新出现的流行病学数据还表明,HCC 的病因风险因素正从病毒相关疾病向非病毒性肝病转变,这对一级和二级预防(包括 HCC 监测)以及治疗都有影响。
原发性预防策略为降低肝细胞癌(HCC)相关死亡率提供了最大的希望,尽管对 HCC 的监测也能通过确保在疾病早期阶段发现病变从而改善患者预后,而此时的病变仍适合采用根治性疗法。遗憾的是,大多数 HCC 患者仍是在疾病晚期才被确诊,这在很大程度上是由于当前监测工具的敏感性不足以及在临床实践中使用不足所致,这表明还有改进的空间。同样,尽管自免疫检查点抑制剂(ICI)疗法问世以来,晚期 HCC 患者的预后有所改善,但仅有约 30% 的患者有客观反应,3 年总生存率仍远低于 50%,这表明仍有改进的空间。
在肝细胞癌(HCC)管理的新纪元之初,我们或许会面临对现有治疗范式的挑战。目前有若干试验正在将新型 HCC 监测策略与标准治疗方案进行对比。未来十年,我们还可能见证基于新组合疗法和新型治疗靶点的更多临床进展。在此背景下,结合 HCC 流行病学的变化,探讨了筛查和治疗策略方面的进展,以及这些进展如何助力医疗保健提供者和系统更好地管理当代 HCC 患者或高危人群。
在2008年,全世界新发肝癌(HCCs)估计748,000例,并且大约696,000人死于这种癌症【1】。而2002年【1】,新发病例为626,000人,598,000死亡【2】。这种大规模发病的主要原因是在欠发达地区,不充分的医疗资源环境导致有乙肝和/丙肝的危险人群患病率较高,并且得不到发现。由于制度和经济的原因,早期肝癌诊断的医疗技术和认识的缺乏,诊断出来也缺乏有效的治疗,也没有“疾病全球经济负担”意识,政府和非政府的专业组织对筛查持有怀疑和消极态度。患者依从性也差,不参与医生建议的监测项目的检查,多数HCCs一经发现多数为晚期,而且多合并有肝功能储备较差,导致这种疾病具有高度致死性,从每年发病率和肝癌死亡的数字相似的数据可以看出这一点。
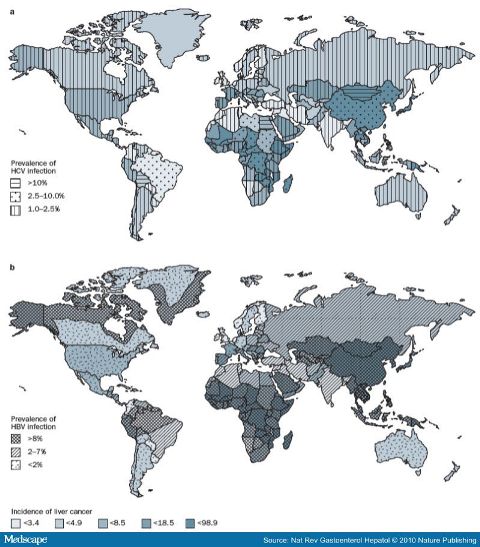
也有说肝癌占癌死亡原因的第四位 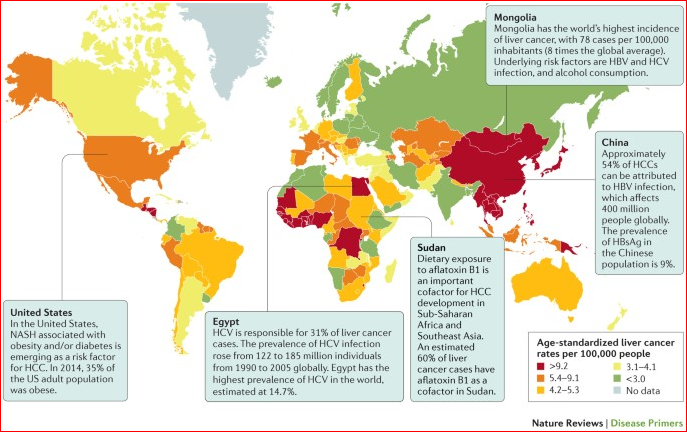 肝癌的发生率全球不一样,发病率最高在蒙古(男性,116.6例/100,000人/年; 女性,74.8例/100,000人/年))[1]。超过80% HCCs发布在发展中国家,包括撒哈拉以南非洲、东南亚和东亚(包括蒙古)。相反,HCCs发病率较低的国家是发达国家,包括北美洲(男性,6.8例/100,000人/年; 女性,2.2例/100,000人/年)、欧洲(除了南欧)、中美洲、南美洲、澳洲和新西兰[1]。HCCs的发生率的全球性变化密切地反映在风险因素上的变化上,HBV或HCV感染大流行的国家通常HCCs发生率高。这一发现与HCCs的大约3/4归因于慢性HBV和HCV传染的事实是一致的。
肝癌全球发病率变化与HBV和HCV感染的关系[2,4,5] 在中国,有关肝癌发病总数的统计资料缺少权威认证,有关亚组发病率的研究也相当稀少。陈建国等人[3]曾对包括香港及台湾在内的中国肝癌发病水平进行估计并作分析。认为中国肝癌总发病数在2000年为34.7万人,考虑"高估"及"遗漏"的因素,估计2000年中国大陆的肝癌发病在28万例左右全国的肝癌发病水平可能为29万例(范围在26万~32万之间),其中男性为21.5万例,女性为7.5万例。 中国十大肿瘤排位
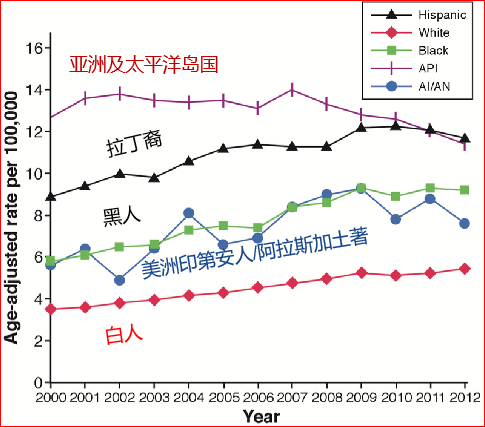
在1978-1992,欧美(包括还拉丁美洲和日本)等发达国家肝癌发病率增加,而在发展中国家减少[6]。例如,美国从1975年到2005年间,超过30年期间HCC的发生率增长三倍(从1.6例/10万人口到4.9例/10万人口) [7],非洲裔美国人是白人的两至三倍。在发达国家病人总数的增加与1960年和1990年之间的慢性丙型肝炎的感染率增加有关(或许还有糖尿病)。HCV被认为是驱动美国这一趋向的主要动力,在慢性丙型肝炎和确诊的肝硬化患者中HCC的年发病率为2–8%。70年代中期以来,日本的HCC死亡率已经增加了3倍多。其中75–80%的病例来自HCV感染(HBV感染为10~15%)。预计2015-2020这一发病率才能逐渐下降[8,9]。因为HCV感染是HCCs主要风险因素,如果HCV感染率下降, HCCs预计也会减少。在美国,随着慢性丙型肝炎的感染越来越少,代谢的综合症的增长和流行,如糖尿病和非酒精脂肪性肝炎 (nonalcoholic steatohepatitis,NASH)被预计是继续造成HCCs增加的主要原因[10]。在美国和欧洲国家来自高危因素发展中国家移民的增加也会造成HCC发生率的上升倾向。
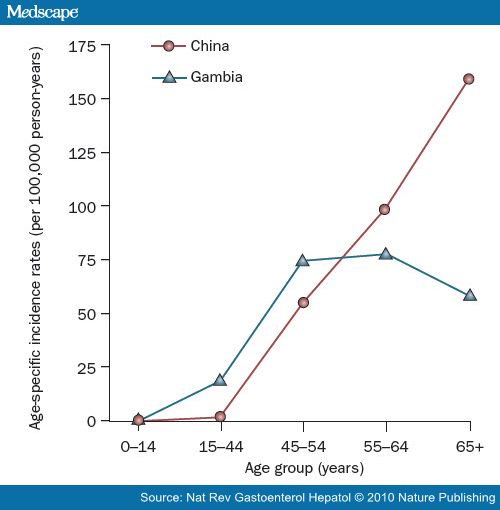
感染HBV或HCV患者HCC形成的年龄是与患者获得感染的年龄以及活跃病毒复制率密切相关。在西部非洲,HBV传染通常在1~5岁之间的年龄,并且病毒复制在青春期以后迅速下降。在这个区域,患者HCC的发生年龄在45岁以后稳定,虽然这观察也许不考虑到有些个体感染HBV的患者,在他们患HCC之前死于其他起因。在东亚,多数病例传染HBV是在1岁之前,并且活跃HBV复制持续到以后的年龄; 因此, HCC的发生率随着年龄增长继续增长,没有一个稳定的状态[11]。西部非洲与东亚比较在病毒复制率上的区别也许与在宿主免疫上的区别有关或在这两个地区发现病毒基因类型上的区别有关。作为在童年病毒感染结果,受影响的个体(特别是在非洲国家)在他们的最具劳动能力的期间罹患肝癌。这个情况导致医疗保健资源的沉重负担,并且受这种疾病的影响,智力和劳力资源在低收入和中等收入惨遭损失。相反地,在乙型肝炎并不流行的国家,HBV和HCV传染通常在成年。在这些国家,HCC很少在50年之前发病,并且最高的特定年龄的发生率通常在75岁以后[12]。
肝癌特定年龄发病率(男性):中国与冈比亚比较
对于肝癌的风险男性比女性高2-7倍,尽管这个比例在世界各地各不相同[6,13]。这种性别差异的解释可能是三个方面:第一,男人可以有更高肝致癌物质(如吸烟或酗酒)的环境接触率和肝炎病毒感染;第二,雌激素的影响可能抑制白细胞介素(IL)- 6 -介导的妇女炎症,从而降低了肝脏损伤和补偿性增生;第三,睾酮的影响可能会增加男性雄激素受体信号,促进肝细胞增殖。[14,15]
肝癌是亚洲第五大常见癌症和第二大恶性死亡原因,2020年亚洲报告的HCC病例占全球的72.5%。作为最常见的组织学类型,肝细胞癌(HCC)占肝癌病例的大多数发病率和死亡率。近年来亚洲国家HCC流行病学的变化。在全球范围内,老年、男性和亚洲人口仍然是HCC风险最高的群体。乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)仍然是HCC的主要危险因素,在大多数亚洲国家略有下降,这主要归功于新生儿乙肝疫苗接种、预防HCV水平传播和治疗慢性肝炎。然而,代谢综合征、肥胖、非酒精性脂肪性肝病等代谢因素引起的HCC在亚洲国家的患病率正在迅速上升,最终可能成为HCC的主要病因。过量饮酒仍然是一个重要的风险因素,因为酒精的平均消费量仍在增长。希望在亚洲大部分地区能够更好地预防和治疗HCC,从而显著延长HCC患者的生存期。与欧美国家相比,亚洲国家倾向于采取更积极的干预措施,但目前尚不清楚这种偏好是否与更好的预后有关。总之,HCC仍然是亚洲的主要疾病负担,HCC的管理应根据流行病学的变化进行动态调整。
中国是一个肝癌大国,每年新发病例数约41.0万人,死亡病例数约39.1万人,可占全球的一半【Chen W 2015;WHO cancertoday;Zhou 2019】。肝癌在我国恶性肿瘤发病率中居第4位,病死率居肿瘤致死病因的第2位[4]。其恶性程度高,进展迅速,预后差,死亡率接近于发病率,患者5年生存率仅12.1%[2],严重威胁着我国人民的生命和健康。
在我国肝癌主要高发于东南沿海地区,如江苏、福建、广东和广西等省份,死亡率以上海、福建、江苏、广州、浙江最高,肝癌男性死亡率在40∕10万以上,而低发区则在3∕10万以下,如云南、贵州、甘肃和新疆。由此可见,肝癌的地区分布很不均匀,没有太明显的规律而言。
1. No. 10 Lyon, France: International Agency for Research on Cancer [online], http://globocan.iarc.fr (2010).
2. The World Health Organization GLOBOCAN 2002 [online], http://www.emro.who.int/ncd/ cancer globocan.htm (2002). 3. 陈建国, 宋新明 中国肝癌发病水平的估算及分析 <<中国肿瘤>>2005年 第14卷 第01期 4. US Centers for Disease Control and Prevention Recommendations for identification and public health management of persons with chronic hepatitis B virus infection [online], http:// www.cdc.gov/mmwr/preview/mmwrhtml/ rr5708a1.htm (2008). 5. WHO International Travel and Health Global prevalence of hepatitis A, B and C [online], http://www.who.int/docstore/wer/pdf/2002/ wer7706.pdf (2002). 6. McGlynn, K. A., Tsao, L., Hsing, A. W., Devesa, S. S. & Fraumeni, J. F. Jr. International trends and patterns of primary liver cancer. Int. J. Cancer 94, 290-296 (2001). 7. Altekruse, S. F., McGlynn, K. A. & Reichman, M. E. Hepatocellular carcinoma incidence, mortality, and survival trends in the United States from 1975 to 2005. J. Clin. Oncol. 27, 1485-1491 (2009). 8. Armstrong, G. L., Alter, M. J., McQuillan, G. M. & Margolis, H. S. The past incidence of hepatitis C virus infection: implications for the future burden of chronic liver disease in the United States. Hepatology 31, 777-782 (2000). 9. Davila, J. A., Morgan, R. O., Shaib, Y., McGlynn, K. A. & El-Serag, H. B. Hepatitis C infection and the increasing incidence of hepatocellular carcinoma: a population-based study. Gastroenterology 127, 1372-1380 (2004). 10. Marrero, J. A. et al. NAFLD may be a common underlying liver disease in patients with hepatocellular carcinoma in the United States. Hepatology 36, 1349-1354 (2002). 11. Evans, A. A. et al. Geographic variation in viral load among hepatitis B carriers with differing risks of hepatocellular carcinoma. Cancer Epidemiol. Biomarkers Prev. 7, 559-565 (1998). 12. El-Serag, H. B. & Rudolph, K. L. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology 132, 2557-2576 (2007).
13.
14.
15.
|