成人和小儿种群的介入放射学的需求越来越多。小儿介入操作反映了许多成人手术,但由于许多考虑因素,尤其是患者的大小,因此复杂性增加。本栏目简要介绍各种血管小儿介入操作。目的是为小儿科医生,介入医生提供更多的治疗选择,并促进了解与各种干预措施相关的成功和并发症率。
血管介入放射学提供广泛的诊断成像和治疗干预。在儿童人群中,很大比例的干预涉及获得中长期血管通路。这一操作在成人人群中相对简单,但在儿科人群中,操作将变得越来越复杂。经动脉手术有许多与成人人群相同的适应证,如动脉出血栓塞。然而,我们需要了解儿科的细微差别,如肾血管性高血压的检查。先天性疾病(如低流量和高流量血管畸形)的治疗可在儿童期进行,从而减轻与之相关的症状和心理影响。本栏目将涵盖在儿科专科中心进行的各种血管儿科介入放射学操作。镇静、凝血病和辐射防护等重要问题已在本网站关于儿童非血管介入放射学的姊妹文章中介绍。
中心静脉通路
儿童中心静脉通路的适应证包括需要全肠外营养;血液透析; 使用某些药物,包括化疗、长时间静脉注射抗生素;静脉切开【J.N. Vo,2010】[1]。外周和中心静脉血栓形成和感染的发生率随着导管尺寸、插入部位、管腔数量、尖端位置、原位持续时间和输液类型【R. DeChicco, 2007 S. Kundu 2009 D.J. Kuter 2004 M. Mansour, 2008】[2]、[3]、[4]、[5]的增加而增加。这些因素应通过使用最小的导管以最短的时间进行优化,放置在最佳的位置。超声引导下可在多种部位插入临时静脉导管,包括股静脉、颈静脉、大隐静脉和上臂静脉循环。在插入任何颈静脉导管之前,任何有凝血病风险的患者都应检查凝血参数。
外周置入中心静脉导管
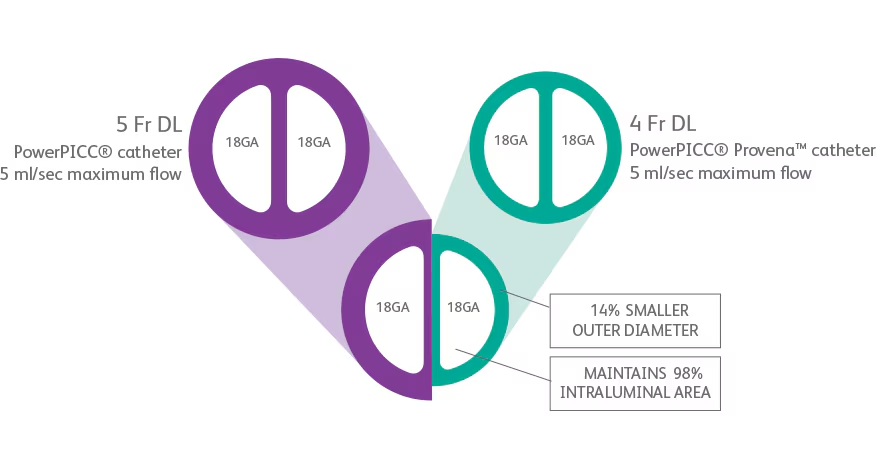
经外周置入中心静脉导管(PICC)提供了良好的中期静脉通路,通常持续数周。PICC有多种类型,管腔法径和管腔数量不同。3F或4F导管对大多数患儿是合理的。Power PICC (Bard Access Systems, Salt Lake City, UT)用于增强CT成像,允许功率注入。
PICC的理想位置通常应将贵要静脉作为入路的主要部位。皮肤进针点应位于肘关节上方,便于肘关节舒适活动,避免弯曲。理想的PICC尖端应在右房腔交界处,即右主支气管下缘或第6后肋间【J.N. Vo,2010 .S. Donaldson 2006】[1]、[6]下方。对于幼儿,可根据手臂位置移动PICC尖端,这一点应在插入时进行评估。位于右心房内的导管可导致几种并发症,包括致死性心脏压塞【J.N. Vo,2010 】[1]。PICC应保持在原位,直到不再需要静脉通路。如果它被阻塞或移位,在尝试重新插入之前不应将其移除。新置PICC更容易。
隧道式中心静脉导管
隧道式中心静脉导管(Tunneled Central Venous Catheters,TCVC)是为中长期的常规中心静脉通路而设计的,例如在血液透析中。这些导管有一个皮下隧道,从静脉穿刺点到导管离开皮肤的地方。在皮肤出口部位的下方,导管有一个环形袖带,允许身体将其纳入隧道组织,这通常需要至少2周的时间,以降低意外移除的风险,并作为一个物理屏障,以防止感染。
所需导管的大小取决于患者的大小和导管的预期用途。理想情况下,非透析儿童患者应使用5F导管,除非导管尺寸较大。透析导管不需要像成人导管那样大,因为所需的流速通常低于成人。右颈内静脉是首选的静脉通路部位;然而,这一选择取决于多种因素,包括是否存在心脏畸形以及未来可能需要形成动静脉瘘。TCVC也可以置入股静脉、肝静脉、肾静脉、颈外静脉、锁骨下静脉和胸腔侧支静脉循环,也可以直接置入下腔静脉(IVC)。理想情况下,血液透析导管的尖端应位于右心房,而输注TCVC的尖端可位于右心房-腔静脉交界处。
植入式静脉输液港
植入式输液港(Implantable Venous Access Ports)包括与皮下输液港相连的中心静脉导管。该输液港由一个具有坚固底的小储液器和一个前间隔组成,这简化了安全的针穿刺。由于输液港没有皮肤成分,因此最适合需要长时间间歇性静脉入路的患者。最常见的适应证是化疗;然而,对于偶尔需要静脉用药(如抗生素治疗感染)的患者(如囊性纤维化患者【J.N. Vo,2010 】)[1],它们也有用。输液港通常放置在皮下脂肪和前胸壁肌肉之间。对于较小的儿童,它们可以放在上臂;然而,这使覆盖的皮肤面临压力的风险
儿童血管造影和动脉介入
儿童血管造影和介入治疗的适应证与成人不同,这是由于儿童不存在动脉粥样硬化性疾病,也包括先天性疾病。诊断性血管造影在很大程度上已被CT和磁共振血管造影所取代,但在某些情况下,常规血管造影的分辨率仍使其成为诊断标准。例子包括肾血管性高血压检查、脑血管病理(如血管炎)评估以及为肢体重建绘制周围血管图【F. Marshalleck 2010】[7]。经导管动脉介入治疗包括器官和外周栓塞、血管成形术和溶栓。
最近,介入放射学学会(Societies for Interventional Radiology)和儿科放射学学会(pediatric Radiology[8])合作发布了涉及儿童动脉通路和动脉造影的指南【M.K. Heran, 2010】8。这些指南涵盖了辐射防护、术前准备、造影剂、适应证、动脉通路和血管造影注射参数等方面。应使用低渗非离子型造影剂,剂量应限制在新生儿4 ~ 5 mL/kg,年龄较大的儿童6 ~ 8 mL/kg。在新生儿中,从导管的死腔中抽吸造影剂可减少造影剂负荷。新生儿也有贫血、液体超负荷和因过量盐水冲洗引起的体温过低的风险,这需要仔细管理所有输入和/或吸入的液体和血液。体重1.5 kg的早产儿循环血量约为147 mL(72小时龄时为98 mL/kg)【R. Usher, J. Lind 1965】9。
大多数侵入性动脉操作是通过股动脉穿刺进行的。偶尔也使用其他通路动脉,包括新生儿的脐动脉。所有动脉穿刺均应在患者超声引导下进行。相对于动脉直径,减小通路鞘直径可降低动脉痉挛和血栓形成的风险【E.A. Franken 1982】。•对于血栓形成有显著风险的病例,建议采用[8]进行全身性肝素化(75 ~ 100 IU/kg【M.K. Heran, 2010】8)。手术结束后,通过手动按压即可轻松止血。然而,必须注意避免过度压迫导致的动脉血栓形成,实现过度压迫的最佳方法是在压迫期间监测远端脉搏、毛细血管再充盈和皮肤颜色。
肾血管造影和介入治疗
肾血管造影最常见的适应证是肾血管性高血压。高达25%的儿童高血压患者有肾血管原因,最常见的是纤维肌肉发育不良【F. Marshalleck 2010】[7]。尽管有CT或MRI血管成像的帮助,但肾血管造影仍然是标准检查方法,特别是因为它能够识别节段性狭窄,而这一点在无创横断面成像中常常被漏诊。偶尔,肾静脉采血可用于尝试定位异常肾素产生的来源。肾动脉狭窄,特别是由纤维肌肉发育不良和1型神经纤维瘤病引起的狭窄,可以通过血管成形术成功治疗)。移植肾动脉狭窄也非常适合血管成形术,根据需要置入支(renal)架。接近100%的技术成功率相当于54% ~ 94%的患者高血压改善或治愈【A. Srinivasan, 2010】[11]。经动脉无水酒精肾动脉栓塞的肾脏消融术(ranal ablation)很少用于单侧肾萎缩的重度高血压患者
脑血管造影术和介入
诊断性脑血管造影术已在很大程度上被CT血管造影术和MR血管造影术等影像学方法所取代。然而,某些病变的诊断需要对小血管进行评估,而在许多病例中,脑血管造影通常可以提供所需的血管炎、脊髓动静脉(AV)分流、脑动脉瘤和AV畸形(AVM)检查中的分辨率,尤其是在较小的儿童中【M.K. Heran, 2011】[12]。此外,各种基于导管的干预措施现在已经很常见,包括血管病变的治疗,如动脉瘤和动静脉畸形,肿瘤的术前栓塞,功能测试(如Wada试验)和急性缺血性卒中的治疗。儿童脑血管造影是一种非常低风险的操作,卒中是最可怕的并发症。术后癫痫发作、一过性皮质盲或脑病罕见【M.K. Heran, 2011】[12]。
肝脾血管介入
在儿童人群中,肝脏介入治疗的适应证多种多样。其中包括肝血管畸形和/或肿瘤的栓塞、创伤性出血、移植后肝动脉狭窄的治疗、肝肿瘤的化疗栓塞和经颈静脉肝内门体分流术(TIPS)治疗门静脉高压。
肝移植干预
肝移植术后肝动脉吻合口狭窄发生率高达20%。肝动脉血栓形成的发生率约为10%。由于大多数狭窄发生在移植后3个月内,因此超声监测对于避免进展为血栓形成至关重要,血栓形成可导致显著的患者死亡率。在这种情况下,肝动脉狭窄的血管成形术最好采用经股动脉途径。在临界性狭窄的情况下,跨狭窄的压力梯度大于10 mmhg是治疗的适应证【R.Miraglia, 2009】[14]。通常应避免在儿童人群中放置支架,并保留用于严重复发性狭窄或血管成形术并发症。急性肝动脉血栓形成的病例可尝试溶栓。球囊血管成形术也是治疗肝静脉和门静脉狭窄的首选方法。
肝动脉化疗性栓塞,(TACE)
经导管动脉化疗栓塞(TACE)是一种广泛用于治疗肝脏肿瘤,尤其是成人肝细胞癌的局部治疗技术。它利用了以下事实:肝肿瘤的大部分血液供应(大约95%)来自肝动脉,而正常肝脏的血液供应主要来自门静脉【F.A. Hoffer 2005】[15]。化疗药物与栓塞平台相结合,注入供应肿瘤的肝段或叶动脉。目前存在多种栓塞平台,包括碘化油(如Lipiodol, Roissy CdG Cedex,法国)和微球。在使用碘油的情况下,在使用化疗-碘油乳剂后再注射栓塞微粒,以减少化疗洗脱和全身暴露。虽然TACE(经动脉化疗性栓塞)是一种姑息性技术,但它可以降低肿瘤分期,有可能通过肝切除或肝移植【C.M. Arcement, 2000 J.P. Li, 2008】[16]、[17]实现治愈性治疗。
在儿童人群中,化疗栓塞已成功用于治疗原发性肝脏恶性肿瘤(如肝母细胞瘤)和肝转移瘤【F.A. Hoffer 2005】[15]。顺铂-多柔比星-碘油TACE已被成功用于肝母细胞瘤的降期治疗,在一个系列中,16例患者中的13例得以切除【J.P. Li, 2008】[17]。尽管如此,5年无事件生存率仍然低于44%,主要原因是微转移。类似的发现已在其他地方中发现【T. Oue, 1998】[18]。
TIPS(经颈静脉门腔静脉分流术)
TIPS是治疗终末期肝病门静脉高压相关并发症的一种少见术式。TIPS治疗门静脉高压症的适应证与成人相同,包括危及生命的静脉曲张破裂出血和顽固性腹水。它可以作为一种原发性姑息的形式,或作为等待肝移植患者的外科分流安置的替代方案。TIPS治疗儿童门静脉高压症的潜在原因包括胆道闭锁、囊性纤维化、先天性肝纤维化、α-1-抗胰蛋白酶缺乏症、移植移植物排斥和病毒性或自身免疫性肝炎【J.M. Lorenz 2008】[19]。
TIPS包括在门静脉和肝静脉之间建立血管内分流。顾名思义,这是通过经颈静脉途径从肝静脉插管门静脉。然后对肝管进行球囊扩张和支架置入。虽然部分覆膜支架(如Viatorr支架 [WL Gore, Flagstaff, AZ])用于成人人群,但对于接受TIPS的儿童患者而言,这些支架可能太大,因为TIPS需要放置覆膜和非覆膜自膨胀支架。根据使用的支架不同,随着患儿的成长,有可能出现支架扩张。手术主要通过透视进行;然而,超声可用于帮助插管门静脉。目的是将门体压差降低到12 mmhg以下。目前报道的技术成功率为78% ~ 100%【J.M. Lorenz 2008 M.B. Heyman, 1997】[19],[20]。并发症包括出血、肝性脑病、分流道狭窄和/或血栓形成、脓毒症、肺水肿或右心衰竭、下腔静脉血栓形成和死亡。由于所使用的儿童支架体积较小,因此需要定期进行超声随访,以便任何狭窄征象都可以早期干预治疗。尽管如此,有报道称通畅率高达81个月【P.E. Huppert, 2002 O. Pozler, 2003】[21],[22]。
脾栓塞
脾肿大
门静脉高压症患者可发生脾大引起的脾隔离,导致高达90%的血小板从循环中被清除【G. Alzen, 2010】[23]。脾大相关血小板减少症的其他原因包括重型地中海贫血、骨髓炎、慢性特发性血小板减少性紫癜和eb病毒等病毒感染。部分脾栓塞术(Partial splenic embolization, PSE)是一种可替代外科脾切除术的方法。它通过保留残余脾组织,避免了全脾切除术中发生大量感染的风险,并且是一种可根据需要重复的微创治疗。
PSE是一项住院病人的操作,包括仔细的病人准备和密切的术后观察。建议栓塞约2 / 3的脾脏,以达到血小板计数升高方面的预期获益。然而,这导致了显著的缺血负荷,以及随之而来的栓塞后综合征(白细胞计数升高、发热和疼痛)。抗生素覆盖率至关重要,一些中心还使用肺炎球菌、脑膜炎球菌和嗜血杆菌免疫。伴明显腹痛的栓塞后综合征常见,通常需要住院长达1-2周【D.M. Israel, 1994】[24]。将栓塞颗粒(通常直径为300 ~ 500 μm)注入脾动脉的二级分支,直至接近淤滞。一些研究人员将栓塞颗粒悬浮于造影剂、青霉素、庆大霉素和利多卡因的混合物中,以提供进一步的抗生素覆盖【G. Alzen, 2010 D.M. Israel, 1994】。该手术技术成功率为100%,在5年时,70%的患者血小板计数保持在100,000 / mm3以上【M. Nio, 2003】[25]。30%的患者在1次PSE后可再次出现血小板减少;然而,该过程可以成功地重复。据报道,TIPS对脾功能亢进无任何显著影响,对血小板值[改善甚微【P.E. Huppert, 2002】21]。然而,PSE可以降低门静脉压力,提示这可能会降低门静脉高压患者静脉曲张出血的风险【G. Alzen, 2010】[23]。
创伤
脾损伤是患儿最常见的实性腹部脏器损伤【A. Kiankhooy, 2010】[26]。儿童脾切除术后感染风险高于成人,应尽量避免脾切除术【P.A. Naess, 2005】(27)。脾栓塞术是外科医师公认的治疗儿童创伤性脾出血的一种治疗策略【D. Li, N. 2009】(28)。
血流动力学稳定的患者可保守治疗;然而,对于病情不稳定或需要持续输血的患者,应考虑脾栓塞。脾栓塞联合保守治疗可使97%的患者保留脾脏。
脾动脉假性动脉瘤(SAP)的最佳治疗方法尚不确定。在成年人群中,SAPs常与延迟破裂相关;然而,由于脾被膜较厚,脾实质较有弹性,儿童可能并非如此【K. Martin, 2010】[29]。尽管研究者报道了儿童SAP的成功栓塞,在一篇综述中有76%的SAP接受了栓塞,但目前尚无足够的良好结局数据来就如何治疗提供普遍共识【K. Martin, 2010】[29]。
脾栓塞的目的是治疗局灶性出血或SAP,而保留脾脏的其余部分。通常用弹簧栓子(Coil)进行;然而,也可使用其他剂,包括液体栓塞剂(例如氰基丙烯酸正丁酯)。虽然栓塞后部分脾梗死引起的疼痛常见,但其他并发症(如脾衰竭和脓肿形成)罕见。
出血的动脉栓塞
动脉栓塞是一种通常在成人人群中进行的出血治疗方法,尤其是创伤性、胃肠道(GI)或肺出血,咯血。然而,尽管一些适应证在儿童人群中相似,但存在重要差异。
血管畸形的介入治疗
血管畸形又分为高流量畸形和低流量畸形。典型的高流量血管畸形为AVM(动静脉瘘),其中毛细血管畸形的发生更为罕见。低流量畸形包括静脉畸形、淋巴管畸形和混合性静脉-淋巴管畸形。诊断通常是在临床检查结合影像学的基础上做出的。超声多普勒检查用于评估许多畸形,尤其是那些位于体表的畸形。由于任何畸形的临床明显部分可能代表“冰山一角”,因此经常进行断层成像(通常是磁共振成像或CT)。低血流畸形,如静脉和淋巴管畸形,在T2加权成像上呈典型的高信号,并且由于静脉石的存在,其内部可能有低信号灶。AVM是高流量病变,因此通常在T2加权成像上呈低信号,并伴有血流空洞(流空信号)。
治疗,无论是保守治疗、手术治疗还是放射治疗,取决于许多因素。在有些机构,有这些畸形的患者由血管异常诊所(Vascular Anomalies Clinic)进行审查,该诊断由一个多学科团队组成,包括放射科(包括诊断和介入放射科医师)、整形外科、皮肤科和与这些患者治疗相关的其他临床服务。然后制定个体化治疗计划,制定具体的治疗策略,并定期进行正式的长期影像学随访。
动静脉畸形(arterial venous malformation,AVM)
AVM是动脉和静脉的异常连接,没有中间的毛细血管床,这导致了一个简单或复杂的连接血管的网络,称为血管巢。40%的脑动静脉畸形在出生时发现,好发于骨盆和四肢【G.M. Legiehn, 2006】[38]。症状取决于AVM的位置和大小,但可由压力效应、出血、静脉高压和房室分流引起【A. Alomari, 2011】[39]。
动静脉畸形的介入治疗可通过动脉、静脉或联合途径进行。治疗病灶的目的是一样的。近端或远端栓塞(即非巢栓塞 农nidal embolization)导致后续血管复张和复发的发生率较高。可以使用各种栓塞剂,包括弹簧圈、液体粘合剂、医用级酒精和Onyx (Covidien, Irvine, CA)。由于许多动静脉畸形是复杂的,有多个供血动脉、引流静脉和巢,可能需要多次治疗。在这种情况下,分期治疗可降低并发症的风险,包括组织缺血和非靶点栓塞。
肺动静脉
虽然肺动静脉畸形(PAVM)可以以非综合征的方式发生,但常见于遗传性出血性毛细血管扩张症患者。1 / 3的出血性毛细血管扩张患者发生PAVM,其本身每百万中有200人发生PAVM【Derek J 2007】[34]。PAVM可引起低氧血症、脑血管缺血、脑脓肿和肺出血。约25%的PAVM患者发生脑血管事件,这是由于静脉栓子未经过肺毛细血管床[40]通常的过滤,从肺动脉向静脉发生右向左分流【J.J. Mager, 2004】(40)。
PAVM通常因其并发症而被检出;但出血性毛细血管扩张患者应定期进行筛查【Derek J 2007】[34]。脉搏血氧仪可检测到任何显著的低氧血症,CT可用于评估任何PAVM的数量和位置。一般原则是治疗供血动脉直径超过3毫米的PAVM。儿童应避免随访CT,因此可以通过运动负荷试验和血氧测定来评估任何显著的右向左分流。
儿童PAVM的栓塞几乎总是在全麻下住院进行。插管全身麻醉使呼吸暂停,从而优化成像。通过股静脉途径进入肺动脉。然后可以使用导向导管或长鞘,以稳定进入目标肺循环。历史上使用弹簧圈栓塞PAVM的供血动脉;然而,引入Amplatzer血管栓(St Jude Medical, St Paul, MN)可以通过单一装置快速闭塞目标供血动脉【B. Cil, M. 2006】[41]。并发症包括弹簧圈或栓子的反常栓塞、心绞痛、短暂性脑缺血发作和胸膜炎。随访是必要的,以监测任何3 mm以下,未闭塞的PAVM的生长。
Galen畸形静脉
Galen静脉畸形是一种非常罕见的畸形,占所有脑动静脉畸形的不到1%【C.K. Sasidharan, 2004】42。临床表现取决于房室分流的程度,新生儿常表现为充血性心力衰竭,不治疗的病死率接近100%【M. Nelson, 1988】43。有时由于脑积水、颅内出血或心脏扩大而在产前通过超声作出诊断,胎儿水肿为。栓塞是一种非常成功的手术【L. Karadeniz, 2011】[44],已被证明使74%接受治疗的患者达到神经功能正常结局【P.L. Lasjaunias, 2006】[45]。Galen静脉畸形的治疗具有极大的挑战性和技术要求。关于何时治疗患者的决定取决于症状的严重程度,文献中有很好的指南【P.L. Lasjaunias, 2006】[45]。该手术经动脉进行,各种栓塞(包括弹簧圈和胶)已被证明有效【M. Nelson, 1988 P.L. Lasjaunias, 2006】[43],[45]。
静脉畸形
静脉畸形(VM)是最常见的血管畸形,其患病率为1%。这些畸形由异常的静脉网组成,其外观各异,可局灶性或弥漫性累及脂肪组织、肌肉和其他组织,通常跨越筋膜平面。大约40%发生在头颈部,类似的百分比发生在四肢【G.M. Legiehn, 2008 】[46]。它们都是从出生时就存在的,而且它们的生长往往与病人的生长成比例。大多数是自发的;然而,其中一些与Klippel-Trénaunay、Maffucci和蓝色橡皮疱痣等综合征相关【G.M. Legiehn, 2008 】[46]。
症状通常由占位效应、局部组织受累、静脉扩张、静脉淤滞以及(罕见的)出血引起。然而,在许多情况下,VMs的首要主诉是外观不佳。与AVM一样,重要的是采用多学科方法,而建立正规的血管异常专科门诊是理想的。这提供了一个环境,患者和他们的父母的期望可以探索,特别是在美容方面。许多VM需要多年的多次治疗以缓解症状。手术切除不被认为是一线治疗。医学摄影提供了治疗的必要记录。
经皮硬化治疗被认为是VM的一线治疗,在X线透视和/或超声引导下进行。简单VM可按门诊流程处理,使用镇静。用乙醇进行硬化治疗可能会非常痛苦,并且总是需要全身麻醉。应避免在神经周围使用。由于有血红蛋白尿的风险,充分补水至关重要,较大的VM可使用酒精治疗。十四烷基硫酸钠是另一种常用的硬化剂,可以通过发泡方便地在超声下显示。其他硬化剂包括多西环素、博来霉素、油酸乙醇胺、聚多卡醇、玉米醇溶醇溶液和鱼肝油酸钠[38]。VM的多个区域可以一次处理;然而,必须注意避免浅表注射,这可能导致皮肤缺血和坏死。经皮硬化治疗后的并发症包括皮肤红斑、坏死、色素沉着、血红蛋白尿、血栓性静脉炎和血栓栓塞【G.M. Legiehn, 2008 A.M. Cahill, 2011】[46]、[47]。静脉注射乙醇还可引起肺动脉血管痉挛、心肺衰竭、高热、中毒和支气管痉挛【G.M. Legiehn, 2006】38。
淋巴管畸形
淋巴管畸形(LM)是一组淋巴管异常扩张的集合。表现为柔软无搏动的肿块,通常在新生儿或儿童中发现。多数发生在头颈部【G.M. Legiehn, 2006】[38]。它们的大小不一,可能由于肿块效应、外观、出血或感染而需要治疗。LM被细分为大囊性、微囊性和混合性LM,并被称为囊性淋巴管瘤和海绵状淋巴管瘤,但不鼓励使用这些术语。硬化疗法可以成功治疗LM,尤其是那些大囊性LM【P. Churchill, 2011】[48]。
硬化疗法包括抽吸LM并注射硬化剂,如多西环素或博来霉素。另一种不需要完全抽吸的成功方案是OK-432(匹西巴尼;中盖制药,东京,日本)。OK-432是用苯苄青霉素孵育的a组酿脓链球菌冻干混合物。它被认为是通过刺激细胞因子的产生而起作用,从而产生局部细胞炎症反应【G.M. Legiehn, 2006 D.A. Peters, 2006】[38],[49]。OK-432通常会引起发热、炎症和肿胀。OK-432和博来霉素治疗大囊性病变的成功率非常相似,均超过80%。博来霉素也会引起发热。然而,与博来霉素用药相关的一种罕见但可能危及生命的风险是肺纤维化【P. Churchill, 2011 D.A. Peters, 2006】[48],[49],这需要对每次治疗和终生进行严格的硬化前评估,以及特定的剂量限制。在头颈部接受治疗的患者从入院监测气道损害中获益。
静脉介入
儿童静脉血栓栓塞(VTE)并不常见,每年每100,000名住院儿童中有4.9人被诊断为VTE。VTE好发于1岁以下和≥15岁的儿童,尤其是女性患者。VTE治疗的核心是抗凝;然而,血栓形成后综合征可导致相当高的发病率。对髂股静脉血栓形成(DVT)、中心静脉血栓形成、下腔静脉血栓形成、双侧肾静脉血栓形成、AV瘘口闭塞、股青肿(phlegmasia cerulea dolens,疼痛性股青肿;蓝色炎性疼痛症;疼痛性蓝肿;蓝色静脉炎 )【L. Raffini 2009 K. Kukreja, 2011】[51]、[52]患者应考虑溶栓治疗。溶栓可以机械进行,或者在没有禁忌证的情况下,加用溶栓药物,如阿替普酶(剂量范围为0.03 ~ 0.1 mg/kg/h;最高1-2毫克/小时。市场上有各种各样的血栓清除装置,从简单的输液导管到复杂的装置,如Angiojet (Possis Medical, Minneapolis, MN)和Trellis (Bacchus Vascular, Santa Clara, CA)。手术后,患者应被送入重症监护病房,仔细监测输注速率并评估潜在并发症。初始导管导向治疗后,通常进行溶栓治疗,并在24小时重新评估静脉造影。如果成功,则应治疗任何潜在的静脉狭窄,然后进行长期抗凝治疗。如果24小时内血栓外观无改善,则继续治疗不太可能取得任何成功。然而,在部分缓解的情况下,可继续溶栓48 ~ 72小时。最常见的并发症是出血,大出血发生率为15%,但无死亡病例【M. Albisetti 2006】。
无论患者年龄如何,IVC滤器的适应证相似。这些主要包括有抗凝禁忌证的DVT或尽管抗凝治疗【K. Kukreja, 2011 L. Raffini, 2008】[52]、[54],但仍发生肺栓塞(PE)。比较有争议的适应证包括漂浮DVT和DVT风险高且有抗凝禁忌证的患者,如多发伤患者。在治疗有血栓栓塞并发症风险的大型VM时,IVC滤器也被用于PE预防。应始终使用可回收的过滤器,以尽快去除它们。IVC滤器对幼儿的适用性不确定,因为大多数滤器都有最小IVC尺寸。儿童患者的长期结局数据也很少;然而,在一小部分11例患者中,没有出现PEs【L. Raffini, 2008】[54]。Gunther Tulip滤器(Cook, Bloomington, IN)已植入3例年轻的儿童患者,其中最小的下腔静脉为2岁患儿,直径为5 mm。当不再需要时,过滤器被成功移除【G. Chaudry, 2008】。
在儿科人群中进行血管介入放射学手术时,与成人人群相比,存在广泛的操作范围,这些操作可能存在细微或重大的变化。对于参与任何处理儿科患者的中心的放射科医师来说,了解这些操作、变化和并发症至关重要。放射科医师可以据此指导临床医生关于介入放射学可以为患者提供的服务。他们还可以正确地解释任何并发症,从而减少患者的发病率和死亡率。
以上林林总总地介绍了儿科介入放射学血管介入的应用。但究竟儿科介入是否值得,创造价值吗?不一定!这么说是因为或许有价值,但没有证实儿科介入放射学的价值,尽管这项技术已经在儿童医院得到广泛的应用,依然缺乏严谨证据证明其比传统外科手术更具价值(如成本效益、生存率提升....)。与其坦诚承认证据薄弱,也比强行论证,甚至大吹大擂地宣扬其成就要好的多。
什么是价值?一个简单的术语,但它在健康方面的意义众所周知,但又很难清楚确定的。立场不同角度不同,对价值的理解也不一样【Bahman Roudsari 2016】[5]。多数患者或患者家庭显然可能会优先考虑更好的患者体验和降低发病率和死亡率,而政府或医保,甚至医院本身被迫采取更广阔的视野。患者可能接受是不同的医疗保险方面服务,哪些费用应该是显而易见的纳入财务分析【Bahman Roudsari 2016】[5]。当比较儿童介入放射学治疗的费用如外科手术,还应考虑间接费用( 如作为父母的请假工时和扣薪或护理费用)被考虑?这些问题Roudsari等总结的很好,他们进行了检查【Bahman Roudsari 2016】,用了不同的方法来分析介入放射学在成人和儿童中的价值。
如何获得价值的证明是个艰巨的挑战。RCT对照实验几乎不可能,受到伦理限制(如无法对儿童进行盲穿活检等落后技术的对照)、技术迭代快(旧方法已被淘汰),且外科医生已主动学习影像引导技术,模糊了专业边界。
现有的研究非常局限。
从手术层面分析如中心静脉植入,儿科介入可能降低并发症和成本【Hancock-Howard 2010】但存在选择偏倚性(外科组更多的事白血病患儿,会增加手术的难度)。
非随机研究结论常被RCT推翻(如胃造口术研究显示PIR并发症更高,但RCT证明无差异)。
-
团队层面分析:多学科团队纳入PIR专家可能优化诊疗(如儿童肿瘤科需处理血管内肿瘤栓塞,,但仅有个案证据(如气管狭窄团队降低成本66%),混杂因素多(如手术技术同步改进)。
核心论证策略:反事实推理。核心观点:儿科介入放射学的价值可通过"若无无儿科介入的负面后果"间接证明。如,PIR成功案例:骨肉瘤患儿通过影像引导放置下腔静脉滤器,预防肺栓塞并同步完成活检/输液港植入。反例:未使用PIR技术的肉瘤患儿发生肿瘤栓塞,导致急性肺栓塞需紧急手术。
-
-
-
证明PIR在预防严重并发症中不可或缺。
-
-
|